| المجلد 6 , العدد 4 , صفر 1433 - كانون ثاني (يناير) 2012 |
| |
| دراسة المُرَاقَبَة الدوائية لمادة زفيرلوكاست وتطبيقها على مجموعة من مرضى الربو |
| Study The Monitoring of Zafirlukast and Apply it on a
Croup of Asthmatic Subjects
|
| د. سلام الشيخ علي وأ. د. أحمد حسن وأ. د. جهاد حربالي |
| AL-Cheikh Ali S; Hasan A. and Herbali J. |
*كلية الصيدلة، جامعة دمشق.
*Faculty of Pharmacy, Damascus University.
|
| الملخص Abstract |
طوّرت طريقة مقايسة تتمتع بالمصدوقية سهلة التطبيق، بتكاليف قليلة لمقايسة زفيرلوكاست في الدم. تعتمد هذه الطريقة على جهاز الاستشراب السائل رفيع الانجاز، باستخدام العمود Purospher star® RP-18 end capped بطول 250 سم وبتعبئة Hypersil-ODS, 5 µ ومكشاف الأشعة فوق البنفسجيّة UV. وكان الطور المتحرك أسيتونتريل v70+ دارئة v30، بمعدل تدفق ml/min1.5 وطول موجة nm242.
إنّ زفيرلوكاست مضاد للوكوترين يُستخدم لمعالجة الربو طويلة الأمد. كان انتقاء زفيرلوكاست مبنياً على دراسة الحرائك الدوائية، لتبيان فيما إذا كان هنالك اختلاف في الحرائك عن ما نشر في دراسات عالمية. وفي هذه الدراسة حُسبت قيم الحرائك الدوائية لزفيرلوكاست لدى 14 مريضاً مصاباً بالربو.
|
A simple, cheap and valid assay was developed to measure Zafirlukast in blood. This method depends on high performance liquid chromatography (HPLC), by using column of Purospher star® RP-18 end capped with 250 cm length, packed with Hypersil-ODS, 5 µ and UV detector. The mobile phase was 70v of acetonitrile added to 30v of buffer, with 1.5 ml/min flux rate and 242 nm wavelength.
Zafirlukast is an anti- leukotriene used for term therapy of asthma. The selection of Zafirlukast was depended on pharmacokinetic studies, to illustrate if there is any difference between these pharmacokinetics and those founded in international studies. In this study, the pharmacokinetics value of Zafirlukast was calculated in 14 patients with asthma.
|
| المقدمة Introduction |
يعّرف الربو بأنّه حالة الْتِهابِيّة للمَسْالك الهَوائِية مع تَعَدّد العوامل السَّبَبِيَّة وتفاوت في تَجَلِّي المَرَض. تفيد مُعَدِّلات اللوكوترين في المعالجة طويلة الأمد للرَّبْو وفي الوقاية (1-6).
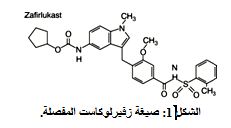
إنّ زفيرلوكاست مضاد انتقائي لمستقبلات اللوكوترين، وهو ببتيد تَخْليقِي المنشأ، صيغته الكيميائية: 4- (5- حلقي بينتيل أوكسي كربونيل أمينو –1- ميثيل - إندول –3- يلميتيل)- 3- ميثوكسي-N- O- توليل سلفونيل البنزأميد
4-(5-cyclopentyloxycarbonylamino-1-methyl-indol-3-ylmethyl)-3-methoxy-N-o-tolylsulfonylbenzamide.
وزنه الجزيئي 575.7 (الشكل 1). وهو مسحوق لا بلَّوْرِيّ أبيض إلى أصفر شاحِب اللون، غير ذَوَّاب في الماء، شحيح الذوبان في الميثانول وذوّاب بسهولة في تتراهيدروفوران والأسيتون والأسيتونتريل ودي ميثيل سلفوكسيد. يعطى زفيرلوكاست عن طريق الفم على شكل أقراص.
يمتص زفيرلوكاسـت سريعاً بعد الإعطاء الفموي، ويقلل الطعام من مُتَوَسِّط التوافر الحيوي للزفيرلوكاست بـمقدار 40% تقريباً. يرتبط الزفيرلوكاست ببروتينات البلازما بنسبة تزيد على 99%، ويكون ارتباطه بشكل أعظمي بالألبومين، كما يستقلب الزفيرلوكاست إلى مستقلبات تتميز بفعالية مضادة للوكوترين، أقل بـ 90 مرة من فعالية مادة زفيرلوكاست، أما الإِفْراغ فيتم عن طريق البول بما يعادل 10% تقريباً، ويفرغ المتبقي عن طريق البراز، ويمكن القول بأنّ الحويصل الصفراوي (المرارة) هو طريق الإِفْراغ الأساسي للزفيرلوكاست.
وردت طرق لمقايسة زفيرلوكاست في الأشكال الصيدلانية وفي الدم في دراسات سابقة، وفي هذه الدراسة جرى تطوير طريقة للمقايسة، تتميز بسهولة التطبيق وسرعة في الانجاز، وبأجهزة متوفرة مع تكلفة قليلة بالمقارنة مع الدراسات الأخرى، وكان هدفنا منذ البداية تنظيم العمل في البحث بمخطط يُحقّقُ الممارسات السريريّة الجيدة الصادرة عن مؤتمر المواءمة الدولي (ICH) International Conference on Harmonization ودليل (GLP) Guideline for Good Clinical Practice, (7) والشكل 2 يوضح مخطط الدراسة.
|
 |
| المواد والطرق Materials and Methods |
1- تطوير طريقة المقايسة وإثبات مصدوقيتها (8-14)
المواد الكيميائية والتجهيزات Materials & Equipments
1- قدّم معمل سـيفكو زفيرلوكاسـت معياري
مرجعي للعمل مع شهادة التحليل الخاصة والمحددة لمواصفاته ومصدره، والتي كانت برقم وَجِيْبَة (تحضيرة)ZAF WS 0801 ، وقدّم لنا أيضاً مادة زفيرلوكاست خام Raw Material مع شهادة التحليل وبرقم وَجِيْبَة (تحضيرة) 380-08TSZL 01/.
استخدمت المذيبات الكيميائية التالية من شركة Merck: أسيتونتريل، إيثانول، ثُلاَثِيُّ الإِيثانولامين، حمض الأسيتيك الثلجي، جميعها خاصة للاستخدام في جهاز HPLC، ماء (حضّر مباشرة من جهاز تقطير لتحضير ماء خاص لجهاز HPLC).
2- مجموعة أنابيب اختبار زجاجية جافة عقيمة محكمة الإغلاق سعتها 5 مل، للاستعمال مرة واحدة لجمع عينات الدم من المرضى، ومحاقن Syringes سعتها 5 مل.
3- منبذة ومجمّدة لحفظ العينات تصـل درجـة
حرارة الحفظ إلى -75°م وبرّاد صغير محمول حافظ للعينات، استخدمناه لضمان انتقال العينات دون أن تتخرب، وميزان حرارة لضبط درجة حرارة الغرفة، والتحكم بالإضاءة كون مادة زفيرلوكاست حسّاسة للنور.
4- حمام مزود بالأمواج فوق صوتية Ultrasonic bath ومقياس الباهاء pH Parameter Martini بمواصفة Specification-Mi151 Ph/ORP Bench Meter ومازج الكتروني، ومراشح ورقية لترشيح المحاليل 45µ وميزان حساس d= 0.01mg Sartorius، وميزان حساس من العلامة التجارية نفسها، إلا أن قيمة d=0.1mg لوزن المواد الأكبر وزناً.
5- إن جهاز الفصل المستخدم هو الاستشراب السائل رفيع الانجاز HPLC ألماني الصنع من شركة Knauer، يتألّف من مضخة تعمل بالتناوب، ومكشاف الأشعة فوق البنفسجية، ومخلية هواء SCM 1000 Degasser وحاقن يدوي وحاسوب Computer مزود ببرنامج خاص لـ Knauer يستخدم لحفظ ومعالجة القيم، عمود الفصل Purospher star® RP-18 end capped 5µ، طوله 250 سم، وقطره 4.6مم.
نمط تعبئة العمود: Hypersil – ODS, 5 µ. زوّد العمود بعمود سابق pre-column وهو عمود صغير مثبت في أعلى العمود يساهم في حماية وزيادة الفصل.
تحضير المحاليل Preparation of Solutions
جرى تحضير كل من محاليـل الغسـل (80% أسيتونتريل+20% ماء) ومحلول الطور المتحرك (30% محلول الدارئة يتألف من ml1 ثُلاَثِيُّ الإِيثانولامين إلى لتر ماء خاص بالـ HPLC + 70% أسيتونتريل) ومحلول الأم المعياري 300µg/ml، ومحلول العمل المعياري 3000ng/ml بعيداً عن الرطوبة والإضاءة وتيارات الهواء في درجة حرارة المختبر 20°م، وأدرجت إجراءات العمل المعيارية الخاصة لتحضير تلك المحاليل، حُفظت المحاليل السابقة للاستخدام في تحضير سلاسل معياريّة مدة شهرين بمكان عاتم وبدرجة حرارة °4+م.
تحضير العينات Samples Preparation
أ- تحضير العينة الشاهدة ضمن الأوساط الحيوية لدراسة مصدوقية الطريقة: أُخذت المصول المُثبت خلوها من الأمراض من مركز بنك الدم التابع لجامعة دمشق، وحفظت ضمن حافظات جافة عقيمة بدرجة -°75م، ورُقّم كل أنبوب برقم يقابل رقم الشخص في المركز. أُخذت البيانات الخاصة بالأشخاص المقتطف منهم الدم، للعودة إليها عند دراسة النتائج، وصنفت كمستندات مصدر Source Documents مع مراعاة عدم ورود أي معلومة معرفة بالهوية تطبيقاً لقواعد الممارسات السريريّة الجيدة (GCP) Good Clinical Practice. وجرى تحضير العينة بالسحب بممص ايبندورف مقدار 0.5 مل مصل، ووضعه في أنبوب تنبيذ، أُضيف إليه 0.25 مل من محلول العمل المعياري، ومُزج جيداً باستخدام مازج دوار مدة 3 دقائق، أُضيف بعد الانتهاء 0.5 مل إيثانول، و1.25 مل أسيتونتريل خاصين بجهاز HPLC. جرى التنبيذ بسرعة 3500 دورة/ دقيقة، لمدة 7 دقائق بعد الخض الجيد، ثم أخذ السائل الطافي وسمّي، بعد الترشيح بمرشحة ورقية µ45، محلول العينة الشاهدة المعيارية 300 ng/ml جاهز للحقن وسجّل التاريخ. أما في حال عدم إضافة محلول العمل المعياري لزفيرلوكاست فتكون تسميته محلول المصل الشاهد الخالي من المادة المعيارية جاهز للحقن.
ب- تحضير عينات المرضى الخاضعين للدراسة للمقايسة بعد ثبات مصدوقية الطريقة: جرى اقتطاف عينات دم بفواصل زمنية 0 و 1.5 و 2 و 3 و 4 و 6 و 9 و11، مقدرة بالساعة عند تناول قرص حاوٍ على 20 ملغ زفيرلوكاست. وكان حجم العينة المقتطفة 5 مل، ولقد أعلم المريض بضرورة عدم تناول الطعام خلال أربع ساعات الأولى من إعطاء الدواء، والسماح بتناول وجبة خفيفة من الأرز والخضار المسلوقة والماء كمشروب بعد مرور 4 ساعات من أخذ الدواء. طُبّق على العينة المقتطفة عمليات التنبيذ، واستخدمنا إيثانول وأسيتونتريل في عملية ترسيب البروتينات، ثم طبقنا عملية الترشيح والحقن ضمن جهاز HPLC. تراوحت أعمار المرضى ضمن المجال 20 – 40 عاماً، حفظت معلوماتهم ضمن استمارة خاصة بكل مريض التي تسمى استمارة تسجيل الحالة Case Reporting Form (CRF) ، وحفظت الاستمارات في اضبارة أُدرجت ضمن مستندات المصدر، لتكون حاضرة للتَفْتيش Audit من قبل فريق ضمان الجودةQuality Assurance (QA)، أو من قبل أي جهة معنية أخرى، أو عند الحاجة للرجوع إليها لمتابعة المريض في التجربة السريريّة، ونؤكد على أنه جرت المحافظة على السرّية Confidentiality بمنع كشف هوية الأشخاص الخاضعين للتجربة، وأعطيت المعلومات للأشخاص المرخص لهم فقط حسب الممارسات السريرية الجيدة الصادرة عن المُؤْتَمَر المُوَاءَمَة الدُوَلِي ICH، جُمعت العينات المقتطعة بعد الاستخلاص في حافظات، وسُجّل التاريخ واسم المستحضر المستقصى مرفق برمز المريض على الحافظة. ووضعت الحافظات في حاوية واحدة خاصة بالاعتيان في المجمدة بدرجة حرارة -°75م. أُعيد تكرار كافة العمليات السابقة 3 مرات، مع الأخذ بعين الاعتبار عدم إعطاء المريض جرعة من المستحضر إلا بعد مرور أسبوع واحد على الأقل، لضمان خلو الجسم بشكل كامل من المادة ولتأمين راحة للمريض.
جـ- تحضير عينة من المستحضر أكوليت (المستحضر العالمي الحاوي على 20 ملغ زفيرلوكاست) للمقايسة أثناء دراسة مصدوقية الطريقة: وزن 20 قرص وسجّل رقم الوجيبة (التحضيرة) وتاريخ الإنتاج والإنتهاء، وعين متوسط الوزن لها. طحنت الأقراص بواسطة الهاون ومزجت جيداً. وزن بدقة كمية من المسحوق المطحون تعادل متوسط الوزن، أي ما يكافئ 20 ملغ زفيرلوكاست، وذلك حسب قاعدة الهرم. نقلت الوزنة إلى بالون معياري عاتم سعته 100 مل. أضفنا إلى البالون 20 مل أسيتونتريل خاص بجهازHPLC، وبعد الخض الجيد لإذابة المسحوق أكمل بالأسيتونتريل إلى خط العيار، وخض جيداً. طُرد الغاز ورشح بمرشحة خاصة قطر مسامها mµ45.
حصلنا بتطبيق ما سبق على محلول مستحضر جاهز للحقن تركيزه نظرياً 0.2 ملغ/ مل.
د- تحضير الشاهد المعياري الحاوي على السواغات فقط لمقايسة المستحضرات الصيدلانية.
ملاحظه هامة: جرت مضاعفة الكميات بالشكل الذي يتناسب مع حساسية الميزان المستخدم، ثمّ لجأنا إلى عمليات التمديد وصولاً إلى التركيز المطلوب.
وزن مقدار 2850 ملغ لاكتوز لا مائي، 2100 ملغ سلولوز دقيق التبلور، 340 ملغ كروس كارميلوز Na، 70 ملغ هيدروكسي بروبيل سلولوز، 50 ملغ شمعات Mg، 30 ملغ بوفيدون، 30 ملغ صوديوم لوريل سلفات، 20 ملغ بولي ايثيلن غليكول، 20 ملغ هيدروكسي بروبيل ميثيل سلولوز HPMC. دوّنت أرقام الوجيبات (التحضيرات) للتوثيق. سحق كل سواغ موزون على حده لتجانس الأبعاد، ثم وضع في هاون أقل السواغات وزناً، ثم أضيف مع الخلط الجيد المساحيق بالتتابع، بحيث تخلط جيداً بعد كل إضافة للمجانسه. أخذ 184 ملغ من الناتج بالاستعانة بميزان حساس، ووضع في بالون معتم (حيث كان متوسط الوزن للقرص 204 ملغ). أضيف بدقة 20 مل أسيتونتريل خاص بجهاز HPLC إلى البالون السابق. وبعد الخض الجيد، مدد بالأسيتونتريل إلى خط المعيار. فُصل الراسب عن السواغات غير المُذابة بالتنبيذ بسرعة 3500 دورة/ دقيقة لمدة 4 دقائق، ثم رشح السائل الطافي وجرى التخلص من الراسب، وسمي السائل الطافي بمحلول الشاهد المعياري الحاوي على السواغات فقط والجاهز للحقن.
هـ- تحضير الشاهد المعياري الحاوي على السواغات والمادة لمقايسة المستحضرات الصيدلانية: وزن 20 ملغ زفيرلوكاست معياري وجرى تدوين رقم الوجيبة (التحضيرة) للمادة المعيارية. ومن ثم أُخذ 184 ملغ من خليط السواغات المحضر في الفقرة/ د/ السابقة، وقسّمت إلى أربع أقسام بالاستعانة بملوق معدني، وأضيف إحدى الأقسام إلى الزفيرلوكاست الموزون، وبعد الخلط الجيد، أُضيفت بقية الأقسام بالتتابع مع الخلط جيداً. نُقل الناتج إلى بالون معياري معتم سعة 100 مل. أضيف له بدقة 20 مل أسيتونتريل خاص بجهاز HPLC. وبعد الخض الجيد مدد بالأسيتونتريل إلى خط العلام. جرى التنبيذ بسرعة 3500 دورة/ دقيقة لمدة 4 دقائق، ومن ثمّ الترشيح لفصل السائل الطافي عن الراسب. رُمي الراسب وبعد الترشيح جرى الحصول على محلول الشاهد المعياري الحاوي على زفيرلوكاست والسواغات تركيزه 0.2 ملغ/ مل وجاهز للحقن.
ضبط الجهاز وملاءمة النظام للمقايسة: جرى تركيب عمود الفصل وتشغيل جهاز الفصل مع كافة ملحقاته، وضبط طول الموجة على القيمة 242 نم، ومجال استجابة مكشاف UV على القيمة 0.005 ثانية، في حال المقايسة للأوساط الحيوية وعلى القيمة 1 ثانية، في حال المقايسة على الأشكال الصيدلانية. مُرر الطور المتحرك بمعدل تدفق 1.5 مل/ د. وضُبطت حجيرة الحقن لتتسع إلى lµ20. حُقن محلول عينة المصل فقط مدة 45 دقيقة، كُرّرت عملية الحقن 5 مرات وحفظت النتائج. حُقن محلول العينة الشاهدة المعيارية 300 نغ/مل مدة 45 دقيقة. كُرّرت عملية الحقن 5 مرات متتالية وحفظت النتائج. لُوحظ وجود قمة عند حقن محلول العينة الشاهدة المصلية المعيارية 300 نغ/مل، عند القيمة 7.154 دقيقة، في حين لم يلاحظ وجود قمة في محلول العينة المصلية الشاهدة الحاوية على المصل فقط.
إن اختيار هذه الطريقة نابع من دراسة البنية الكيميائية لزفيرلوكاست فهي مادة عضوية قطبيتها ضعيفة، تتمتع ببنية فراغيّة ضخمة حاوية على وظائف حمضيّة ووظائف أساسية، ساهمت الإعاقة الفراغية الناتجة عن بنيته الفراغيّة في عدم إظهار الوظيفة الأساسية للنتروجين المتواجد في نواة الأندول، وبالمحصلة نجد أنّ الوظيفة الحمضّية هي السائدة. حُسبت قيمة Pka = 3.37 (4) من قبل مركز Chemical Abstracts Service في الولايات المتحدة الأمريكية. إن مادة زفيرلوكاست ذوّابة في المذيبات العضوية كالأسيتونتريل والأسيتون وغير ذوابة في الماء. فيمكن فصل مادة تتمتع بهذه الصفات اعتماداً على الهجرة التفاضليّة الديناميكية التي تتميز بها طرق الاستشراب. انتقينا الاستشراب السائل رفيع الانجازHPLC كتقنية فصل مناسبة ومتوفرة. وانتقينا من الأعمدة العمود C18 الذي يتلاءم مع مواصفات زفيرلوكاست، حيث الطور الثابت لا قطبي، وهو سطح كاره للماء مكون من جزيئات مرتبطة على السيليكا C18، آخذين بعين الاعتبار القاعدة التي تنص على أنّ زمن احتباس Retention time المادة المحللة سيتعلق بقطبية المادة، كما درسنا طيف الامتصاص الضوئي لزفيرلوكاست لتحديد طول موجة الامتصاص الأعظمي باستخدام مِقْياس الطَّيفِ الضَوئِيّ Spectrophotometer، وكان الناصع أسيتونتريل والعينة عبارة عن زفيرلوكاست مذاب بالأسيتونتريل تركيزه 10 نغ/مل، وتبيّن لنا أنّها 242 نغ، واستبعدنا الاستشراب الغازي GC لأنّ المادة غير ثابتة حرارياً.
|
| |
إثبات المصدوقيّة Validation(8، 16)
يُعبّر عن المصدوقية بمجموعة من المتثابتات التحليلية Analytical Parameters:
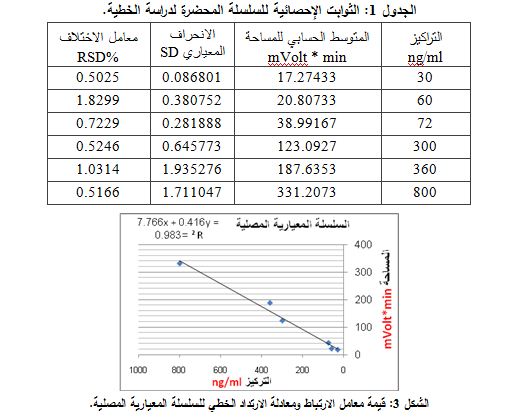
1- الخطية: جرت دراسة ملاءمة النظام، ومن ثم تحضير سلسلة معيارية مصلية مكونة من 5 تراكيز، آخذين بعين الاعتبار أن تكون هذه التراكيز ضمن المجال الذي سيقاس في الدم، حقنت السلسلة في جهاز الاستشراب مع الأخذ بعين الاعتبار تكرار الحقن ثلاث مرات لكل تركيز، كما دونت النتائج، وأدرجت الثوابت الإحصائية للسلسلة في الجدول 1.
نستنتج من معامل الارتباط الذي قيمته 0.9836 أنّ الارتباط طردي، فقيمته موجبه ومتين جداً لأنّه أكبر من 0.9، وهذا يثبت أنّ العلاقة خطية في الأوساط الحيوية (المصلية).
2- المجال: تبين أنّ الطريقة خطية ضمن المجال ng/ml30–800. وهذا أيضاً تم استنتاجه بعد تحضير سلاسل متدرجة التراكيز.
3- الحد الأدنى للكشف = ng/ml9.27 والحد الأدنى للقياس الكمي = .9 ng/ml30، حيث كان الضجيج noise=3.09 عند حقن ناصع الأوساط الحيوية.
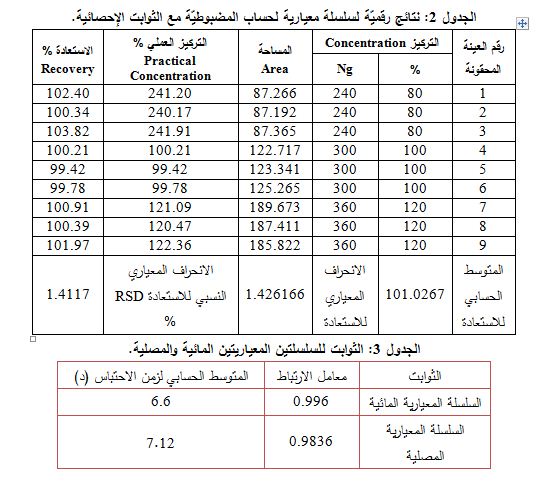
4- المضبوطيّة: أيضاً بعد دراسة ملاءمة النظام، جرى حقن محاليل العينات التسع التالية لحساب الاستعادة، فأعطت النتائج المبينة في الجدول 2.
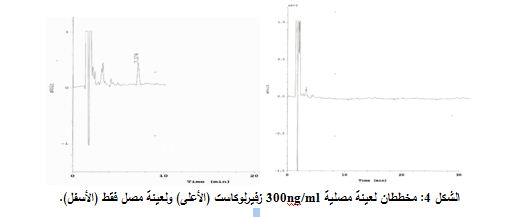
5- الانتقائية: جرى تحضير سلسلتين مائية (أي عدم وجود مصل) ومصلية. ووجد عدم تداخل قمة زفيرلوكاست مع بقية القمم الموجودة في كلا السلسلتين والجدول 3 يبين الثوابت.
لم تلاحظ قمم عند حقن أسيتونتريل خاص بجهاز HPLC في الأوساط المائية ضمن المجال من 4-11 د.، في حين لوحظ وجود قمة عند حقن المحلول المعياري الشاهد 300 ng/ml.
أما بالنسبة للأوساط الحيوية، فيُظهر الشكل 4 نتائج هذه الدراسة.
راقبنا قيم معامل التذييل Tailing–Factor وكانت ضمن المجال المقبول والوسطي 0.96، كما أظهرت النتائج أن متوسط عدد الصفائح النظرية 7803 والقيمة مقبولة (أي أنها انتقائية).
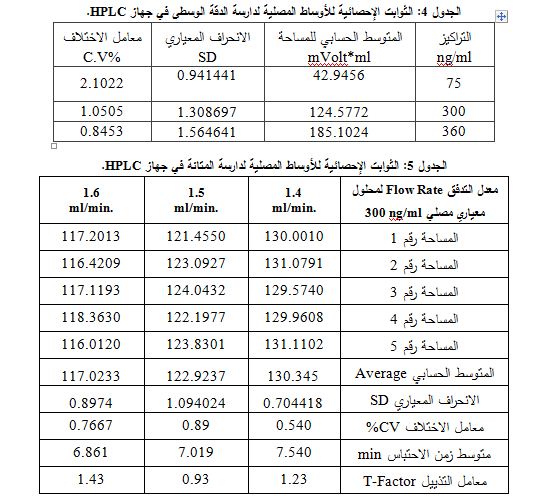
6- الدقة: يجري التعيين بالدقة الوسطى: جرى في بداية كل يوم دراسة لملاءمة النظام، ومن ثم حقن سلاسل معيارية لزفيرلوكاست متدرجة التراكيز وبفواصل زمنية قصيرة، حيث كانت التواريخ 9 و15 و16 و23 و30 /7/2008 و7 و 14 و21 و28 /5/2008 و4/6/2008. و بالمحلل نفسه والأجهزة ذاتها وفي المكان نفسه (الجدول 4).
كما تعين الدقة بالتكرارية: حُضرت سلسلة معيارية مؤلفة من 3 تراكيز ng/ml75 (25%) و300 (100%) و360 (120%)، وحُقن كل تركيز 3 مرات على التتالي، فكان المتوسط الحسابي للاستعادة =100.9856 ، ومعامل الاختلاف = %2.01 للأوساط المصلية، وهذا دليل على جودة التكرارية.
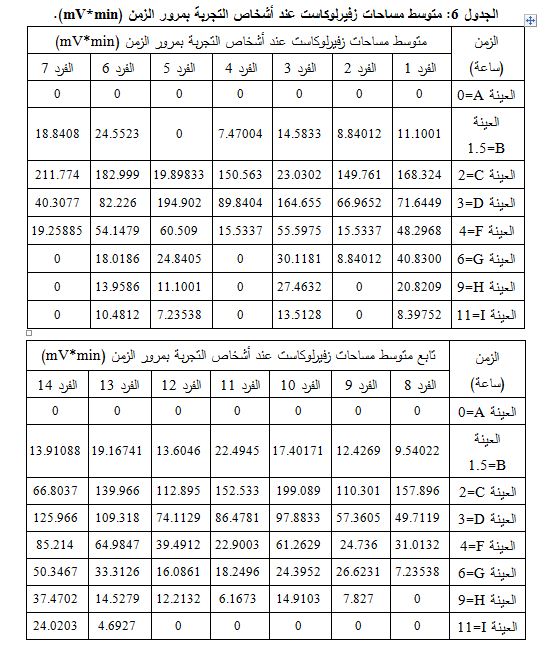
7- المتانة: مقياس لقدرة الطريقة على بقائها غير متأثرة بالتبدلات الصغيرة الموضوعة بشكل معتمد في معايير الطريقة، جرى تبديل معــدل
التدفق فحصلنا على الجدول 5.
كانت جميع القيم السابقة لمعامل الاختلاف أقل من 2%، وكانت قيم عامل التذييل المميزة لكفاءة العمود ضمن الحدود المقبولة، وبالتالي نقول إنّ الطريقة تتمتع بالمتانة.
2 - دراسة ثوابت الجودة الصيدلانية للمستحضرات التي ستقدم للمرضى
المستحضر المستقصى المقدم للمرضى في الدراسة هو مستحضر أكوليت Accolate® برقم تحضيرة P1 343154 من شركة أزترزينكا. جرى عليه تطبيق فحوصات شامله ابتداءً من الفحص العياني لمواد التعبئة وانتهاءً بفحص محتوى الأقراص من مادة زفيرلوكاست. اعتُمد للمقايسة الطريقة السابقة نفسها، مع تعديل استجابة مكشاف UV لتصل إلى 1 ثانية. وجرى التأكد من مصدوقيتها في حال تطبيقها على الأشكال الصيدلانية، باستخدام محاليل الشاهد المعياري الحاوي على السواغات فقط لمقايسة المستحضرات الصيدلانية والشاهد المعياري الحاوي على السواغات ومادة زفيرلوكاست المعيارية لمقايسة المستحضرات الصيدلانية. جرى قياس محتوى أقراص أكوليت من مادة زفيرلوكاست، وتبين أنه يحتوي 97%، وهو ضمن المجال المقبول الذي هو من 90-110%، وكانت النتيجة بمعامل اختلاف أقل من 2%.
3- انتقاء المرضى وتحضير العينات(7)
جرت الدراسة على مجموعة من المرضى الذكور المشخص لديهم الإصابة بالربو والذين اقترح تقديم زفيرلوكاست ومونتيلوكاست لهم كمادة علاجية من مستشفى المواساة. دوّنت القصة السريرية وقيم الفحوصات على استمارات (CRF) جرت تعبئتها في شهر 11/ 2006. أعطي رمز (Subject Identification Code) لكل مريض، حفاظاً على السرية. وأعطيت المعلومات للأشخاص المرخص لهم فقط. ثم جرى استبعاد المرضى المصابين بمشاكل كبدية وكلوية، والذين لا تتوافق مواصفاتهم مع متطلبات بحثنا، كالذين لديهم ارتفاع في قيم وظائف الكبد أو الذين تجاوزوا الستين عاماً أو عند وجود تحسس لمادة زفيرلوكاست. جرى إعلام المرضى بنمط وآلية التجربة، والتأكد من التزامهم بخطة الدراسة ومن سلامتهم تطبيقاً للمرسوم التشريعي رقم /37/ وتطبيقاً للممارسات السريرية الجيدة. أما تحضير العينات فلقد أوردناه سابقاً. كما يجب أن يكون المرضى غير مدخنين وغير كحوليين، ووجباتهم خلال فترة الدراسة منخفضة الكافئين.
4- تطبيق طريقة التحليل على عيّنات المرضى بعد أن جرى إثبات مصدوقية الطريقة والتحقق من جودة المستحضر، قُدم هذا المستحضر للمرضى وأخذت العينات بفواصل زمنيّة محددة. مُررت العينات في جهاز HPLC، مع التأكيد أنه بتطبيق ما سبق ستكون النتائج متعلقة فقط باختلاف طبيعة الأشخاص الفيزيولوجية الاستقلابيّة.
جرى الحصول على التراكيز في الدم بتعويض قيم المساحات في معادلة الارتباط الخطية، وهي
Y = 0.416X + 7.7666
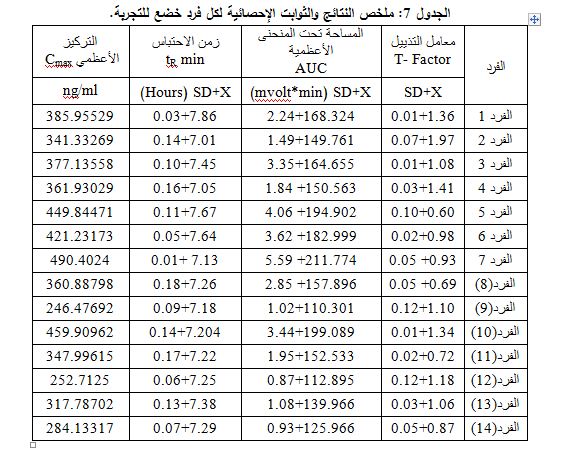
حيث Y: المساحة تحت المنحنى وX: هو التركيز المطلوب. وأُدرجت الثوابت الإحصائية الخاصة بكل فرد Subject خضع للتجربة عند زمن التركيز الأعظمي في الجدول 7.
|
|
| مناقشة النتائج Results Discussion |
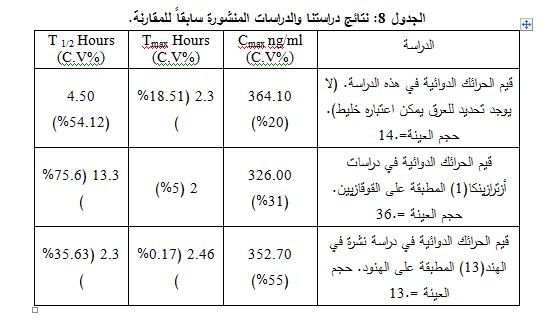
يبين الجدول 8 قيم الحرائك في الدراسات المنشورة سابقاً وفي هذه الدراسة.
تعد الدراسة الصادرة عن أزترازينكا(1) من أقدم الدراسات المنشورات حول المستحضرات الحاوية على زفيرلوكاست. ولقد أكدت هذه الدراسة أن قيم الحرائك الدوائية لا تختلف باختلاف الأشخاص، إلا أنه، وبعد مرور فترة زمنية على استخدام زفيرلوكاست، أشار المركز الأمريكي لجمع المعلومات الطبية من الأبحاث والدراسات Up To Date إلى ظهور شكوى في عدد من المراكز الطبية لتكرار وجود آثار ضائرة تُعد، حسب منشورات أزترازينكا، نادرة الحدوث. وكذلك حالات عديدة من عدم حصول المريض على التأثير العلاجي المطلوب، فظهر سؤال حول الأسباب التي جعلت من هذا المستحضر لا يعطي التأثير العلاجي المطلوب لبعض الأشخاص. ومن ثم نشرت دراسة في مجلة Journal Allergy Asthma Immunol عام 2005 (17)، أشارت إلى وجود اختلاف في القيم الحرائك، فلوحظ مثلاً أن قيمة عمر النصف للدواء تساوي ساعتين، في حين كانت في دراسة أزترازينكا 11 ساعة. ولو قارنا الدراستين لوجدنا أن الأولى طبقت الدراسة على القوقازيين والثانية طبقت على الهنود، أي أنه من الممكن ترجيح وجود اختلاف عرقي. ومن هذه النقطة انطلقت دراستنا هذه، لتطبق على المرضى الذين يمكن اعتبارهم خليطاً، لبيان في ما إذا كان هنالك بالفعل اختلاف عرقي. وبالنظر لنتائج هذه الدراسة نجد أنها رجحت الدراسة الثانية حول وجود اختلاف في قيم الحرائك الدوائية، ونلاحظ أن القيم الناتجة كانت مختلفة عن القيم الناتجة في كلا الدراستين. وهذا يعزز أن الاختلاف عائد للطبيعة الفيزيولوجية الاستقلابية للشخص، ومن الممكن أن يعزى الاختلاف لكون نسبة ارتباط زفيرلوكاست بالبروتين في هذه المجموعة أقل من ارتباطه لدى القوقازيين، أو يعزى إلى اختلاف في التوزع، وهذا له علاقة بالعوامل الوراثية، حيث قد يكون حجم التوزع لدى القوقازيين أكثر من غيره من المجتمعات. ومن الضروري أن نقوم بمزيد من الاستقصاءات لبيان هل هنالك علاقة للبيئة المحيطة أيضاً بالإضافة للتأثيرات الوراثية.
|
| التوصيات Recommendations |
نوصي باستخدام طريقة المقايسة التي طورناها في رصد زفيرلوكاست لدى المرضى. فالطريقة تتمتع بالمصدوقيّة، والأجهزة متوفرة، ولو حسبنا التكلفة المادية لوجدناها أقل مقارنة مع المقايسات الأخرى المنشورة سابقاً.
كما نوصي الطبيب قبل اعتماد زفيرلوكاست للمريض، سواء للوقاية أم العلاج، بأن يعدل المقدار الجرعي بناءً على الطبيعة الاستقلابية للمريض، وقد يكون وجود الاختلاف في قيم الحرائك الدوائية سبباً في عدم حصول المريض على التأثير العلاجي المطلوب، ومفسراً لأسباب اختلاف التأثير العلاجي بين الأشخاص، وظهور حالات من التأذي نتيجة استخدام هذا الصنف.
|
| المراجع References |
1-Accolate® Documents Approved by FDA, copyright 2009-2010 AstraZeneca.
2-Roger Walker & Clive Edwards, Clinical Pharmacy and Therapeutic, Third Edition, copyright, CHURCHILL LIVINGSTONE, pages 375-397 and pages 3-13, 2003.
3-Finkel Richard, Clark Michelle. A. Cubeddu. Luigi, "Pharmacology", 4th edition, copyright, Lippincott's Illustrated Reviews, 2009.
4-John H. Block & John M. Beale
Organic Medicinal and Pharma-ceutical Chemistry, Eleventh Edition, Copyright Lippincott William & Wilkins PA,USA, Pages 948-956 and pages 818-822, 2004.
5-Savidge R.D; Bui K.H; Birmingham B.K; Morse J.L. and Spreen R.C.
Metabolism and Excre Tion of Zafirlukast in Dogs, Rats and Mice.
Drug Metabolism & Disposition 26, 11, Copyright © by The American Society for Pharmacology & Experimental Therapeutics Determin-ation, Pages 1069-1076, 1998.
6-Jeff D. Fischer, Min H. Song A. Benjamin Suttle, William D. Heizer, Charles B. Burns, Kim L.R. Brouwer
Comparison of Zafirlukast (Accolate®) Absorption after Oral and Colonic Administration in Humans, Pharmaceutical Research, 17, 2, copyright Pages 154-159, 2000.
7-ICH (International Conference on Harmonization) Guideline for Good Clinical Practice, The Institute of Clinical Research, copyright, 1996.
8-Max Feinberg, Validation of analytical methods based on accuracy profiles.
Journal of Chromatography A, 1158 174-183, 2007.
9-Richard Dekhuijzen P.N. & Peter P. Koopamans, Pharmacokinetic Profile of Zafirlukast, Clin Pharmacokinet copyright 41 (2) Pages 105-114, 2002.
10- Fifield F.W. and Kealey D.
Principles and Practice of Analytical Chemistry, Fifth Edition, copyright Blackwell Science, Pages 37-170, 2000.
11-Incilay Süslü, ?eyda Demircan, Sacide Alt?n?z & Sedef K?r "Optimisation, validation and application of a capillary electrophoretic method for the determination of zafirlukast in pharmaceutical formulations.
Journal of Pharmaceutical and Biomedical Analysis, 44 (1): Copyright © Elsevier B.V; Pages 16-22, 2007.
12-Daived Harris, Sandra Kiselica, and Lauren Oliveira, Principles of Instrumental Analysis, Sixth Edition, copyright 2007 THOMSON BROOKS/COLE, USA, CA.
13-Douglas A. Skoog, Donald M. West, F. James Holler and Stanley R. Crouch,
Fundamentals of Analytical Chemistry, Eight Edition, copyright 2007 Thomson Brooks/ Cole.
14-Clifton E. Meloan,
Chemical Separations principles, techniques, & Experiments
Copyright 1999, A Wiley-Inter science Publication John Wiley & Sons, Inc.
15- Radhakrishnaa T; Satyanarayanab J. and Satyanarayana A.
Determination of zafirlukast by stability indicating LC and derivative spectrophotometry.
Journal of Pharmaceutical and Biomedical Analysis, 30 (3): Copyright© Elsevier Science Pages 695-703, 2002.
16-United States Pharmacopoeia (USP30-2007).
17-Shubha Rani, Swati Guttikar, Anjali Zope, Manish Nivsarkar, Harish Padh. "Zafirlukast Pharmacokinetics in Healthy Indian Male Subjects: Interethnic Variability".
Pharmaceutical Education and Research Development center, Indain Journal Allergy Asthma Immunol,
19 (2) copyright 69-73, 2005.
|
| |
| المجلد 6 , العدد 4 , صفر 1433 - كانون ثاني (يناير) 2012 |
|
|
|
