| الملخص Abstract |
تقسم الواصمات السرطانية تبعاً لمراحل المرض المختلفة إلى: السريرية، التشخيصية، المراقبة، الإنذار Prognosis، اختبارات الوقاية والحماية، في المستقبل المنظور القريب. وفي واقع الحال، إن الواصمات السريرية التقليدية، الممتدة من المُسْتَضِدِّ السَرَطانِيِّ المُضْغيِّCarcino Embryonic Antigen (CEA) إلى المستضد النوعيّ لغدة البروستات Prostate-Specific Antigen (PSA)، إلى الواصمات الجينومية Genomic Markers، لم تصل بنا خلال العقدين المنصرمين إلى التوقعات المرجوة بالكشف أو التشخيص المبكر للمرض.
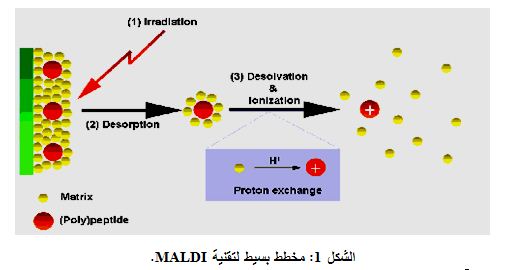
يتوفر حالياً حوالي 50 واصم سرطاني سريرياً، يُستخدم بعضها في الدول الأوروبية واليابان. وإنَّ تطبيق الواصمات السرطانية في الولايات المتحدة مُحدّد بمراقبة وتطور المرض وليس تشخيصه، - ماعدا الـ PSA وواصم بروتين المطرس النووي Nuclear Matrix Protein (NMP)، وذلك بسبب ضعف حساسيتها في كشف الورم في مراحله المبكرة. كما أن استخدام CA19-9 وCA125 جرت الموافقة عليه عام 2002 من قبل النظام الصحي الرسمي في الولايات المتحدة. وفي الواقع بُذلت جهود هائلة لإيجاد طرق تشخيصية أفضل لتشخيص الأورام، ولقد استخدم نموذج التَّحَوُّف (الخط) المنطقيُّ Logistic Regression Model المتمثل باستخدام عدة واصمات وذلك لتحسيـن الحساسيـة والدقة في التشخيص، لكـن مـع نجاح محـدود، ويُعتقـد بأن تطبيق المقايسة البروتينية- الجينومية Proteomics Assay، وخاصة تأين/ الْتِفاظ الليزر المطرسي Matrix Laser Desorption /Ionization (MALDI)، سوف تخدم كوسيلة جديدة لتحسين تقانة التحاليل متعددة الواصمات وكذلك لاستكشاف واصمات جديدة (الشكل 1).
ترتبـط التحولات السـرطانيـة الخبيثة بطفرات أو بتبدلات في الجينُات الوَرَمِيّة Oncogenes أو حتى في الجينات الكابتة Suppressor Genes. ويجري كشـف تبدلات الجينات الكابتة بشكل أوسع وأشـمل من كشـف تبدلات الجينُات الوَرَمِيّة. وفي الغالب تساهم الجينُـات الوَرَمِيّـة
في الخلايا السرطانية في التنظيم صُعداً Up-regulate لإشارات النمو التحوليّ، بدءاً من مرحلة النسخ إلى مرحلة النمط الظاهري النشيط للورم؛ في حين أن نشاط الجينات الكابتة يُقلل من من تنظيمها صُعداً، فهي تُصلح Repair الدنا DNA وتحافظ على هويته. وبالتالي فإن الواصمات السرطانية هي واصمات مرتبطة بمستضدات السرطنة. ومن وجهة نظرٍ سريرية تطبيقية، فإنَّ الواصمات الجينومية يمكن أن لا تكون جذابة، كما كان متوقعاً. وبالإضافة لذلك فإنَّ المعلومات المتوفرة عن الأبحاث الجزيئية، قد سمحت ومهدت الطريق للدخول في المسارات الجزيئية لنمو السرطنة الخبيثة لدى البعض من أنواع السرطان. وإنَّ العديد من أدوية العلاج السرطانيِّ الموجه قيد التطوير حالياً. وفي مجال علم الأدوية الجينومي Pharmacogenomics فإن التشخيص مطلبٌ لتحديد سبب الورم لكل حالة مريض. ويجري عادة اصطفاء واستخدام واصمات جزيئية جديدة، بغية أن يكون العلاج أكثر دقة مع أقل الأعراض الجانبية، عند استخدام الأدوية السرطانية الموجهة بدلاً من الأدوية السرطانية التقليدية. ويبدو أن هذا الحقل من التشخيص والعلاج يلقى اهتماماً ويبدو في حالة توسع مع المزيد من الأبحاث القائمة حالياً.
|
 |
| 1. فوائد ومقيدات الواصمات السرطانية التقليدية في المصلAdvantages & limitations of conventional tumor markers in serum |
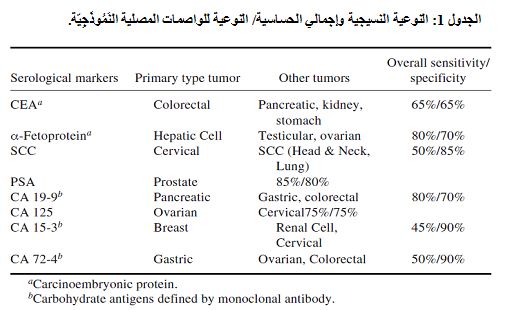
لقد كان تطوير الحَواتِم Epitopes أو الجزيئات السرطانية النوعية مخادعاً، على الرغم من الجهود الهائلة المبذولة في البحث الطبي. ويُظهر الجدول 1 الخصائص الإجمالية للواصمات السرطانية الشائعة مع بيان إجماليِّ حساسيتها Sensitivity ونوعيتها Specificity، علماً بأنه جرى تطوير 50 واصم سرطانيٍّ خلال 50 سنة ماضية. فلقد اعتمد CEA كواصم سرطاني نوعي لسرطان المستقيم- القولون colorectum. ومن وجهة نظر الحساسية والنوعية عند النقطة الحدية Cutoff point لكل واصم، فإنَّ CEA ليس مناسباً لأهدافٍ تشخيصية. ويعد ألفا- فيتوبروتين -Fetoprotein α ذا حساسية أعلى من CEA وذلك بنسبة 80%، إلاّ أن نوعيته أقل وذلك بسبب إيجابية الأورام الحميدة.
يعد CA19-9 أول واصم سرطانيّ يُنْتَجُ بوساطة ضد وحيد النسيلة Monoclonal Antibody. يقوم هذا الضد بتمييز حاتمة Epitope سلسلة سكرية وليس جزيئة كاملة للمستضد السرطانيّ. توجد هذه الحاتمة على أنواع مختلفة من الجزيئات. ويُبدي هذا الواصم نسبة حساسية 85% ونوعية 70% لسرطان البنكرياس. ويعد واصم غدة البروستات PSA، لامتلاكه أعلى نسبة حساسية 85% ونوعية 85%، أفضل واصم سرطانيٍّ لغدة البروستات. في حين أن كلاًّ من CA15-3 (واصم سرطان الثدي) و CA72-4 (واصم سرطان المعدة) ذو حساسية منخفضة ونوعية عالية.
وكما هو ملاحظٌ من الجدول 1، فإن بعض الواصمات لا تُظهر حساسية أو نوعيةً كافية لأجل التشخيص والتقصي. ويعد الـ PSA الواصم السرطاني الأكثر حساسية وهو ذو نوعية عالية لغدة البروستات، إلا أنه نوعي في سرطان الخلايا الحرشفية Squamous Carcinoma وليس نوعياً في نسيج محدد، أما بقية الواصمات فهي أقل نوعية لأعضاء الجسم.
يبدو أن الواصم يزداد في المصل مع ازدياد حجم الورم السرطاني. كما أنَّ نسبة حساسية التقصي متناسبة مع تقدم الورم. وإذا جرى تطوير واصمات سرطانية بدون قيم حدية Cutoff Value في المستقبل القريب، عندئذٍ هناك حاجةٌ لطريقة تقصٍ أكثر حسـاسيةً لكشف المراحـل
الأبكر من تنامي السرطان. ويبدو أن الـ PSA هو الذي يُظهر أفضل حساسيةٍ في المراحل المبكرة. يرتفع مستوى الـ PSA في المصل حتى إذا كان حجم الورم أقل من 1 سم قطراً. كما أن واصم سرطان المثانة، NMP في عينات من البول، له حساسية واصم الـ PSA نفسها في المراحل المبكرة. لكن، من أجل تحسين حساسية ودقة التشخيص، جرى استخدام خوارزميات حسابية معتمدة على عدة واصماتٍ للعديد من الأورام، وبعضها أدى إلى إحراز تقدم في مجال تحسين حساسية التقصي. إلاّ أنه لم نحصل بعد على نتائج قطعية. ويجري البحث عن طريقة أكثر حساسيةً، باستخدام تقانة تحليل البروتينات الجينومية Proteomics Analaysis بصورة خاصة. حيث تسمح هذه التقانة بقياسٍ متواقت لمئاتٍ من المتثابتات الاختبارية Test Parameters في مصل المريض، باستخدام رقاقة التحليل البروتيني الجينوميّ. لكن إلى الآن لا يوجد سوى تقريرين عن استخدام مثل هذه التقانة كوسيلة واعدة في مجال تشخيص الأورام.
|
 |
| 2. التعيين الجزيئي للأحماض النووية كواصمات سرطانيةNucleic acid molecular determination as tumor markers |
قدم علم البيولوجيا الجزيئي والتحليل الوراثي الكثير من أجل فهم بيولوجيا السرطان. فلقد عُلِمَ بأن تطفير مورثة معينة أدى إلى تكوين عدة أورامٍ موروثة. ولقد جرى تحديد مئات المورثات السرطانية والكابتة للسرطان. ولذلك فمن المرتقب الحصول على مزايا كثيرة من جراء استخدام الواصمات الجينية Gene Markers في مجال تشخيص السرطان. وبالإمكان تلخيص أهمية الأحماض النووية بالعلاقة مع الأورام كما يلي:
- طفرات المورثات السرطانية والكابتة لها؛
- كبت المورثات الكابتة عبر مثيلة جذر CpG أو عدم ثبات منطقة المِعْزاز Promoter؛
- مخطط واقع حال الخلية الجسمية على مستوى الـ mRNA؛
- طفرات السَواتِل الدقيقة Microsatellite mutations (عدم ثباتها)؛
- ثبات نهايات الصبغيات Telomere stability ونشاط إنزيم التيلوميراز Telomerase activity.
إن غالبية الجينات السرطانية ذات الصلة بنقل الإشارة Signal transduction عبر مسارات داخل الخلية، تسبب تشكيل الأورام من خلال طفرات تؤدي إلى تعبير زائد لتلك المورثات وذلك بفعل تطفيرها، وبشكلٍ خاص المورثات ذات العلاقة بـ ras. ولقد ساهم التآزر بين الجينات السرطانية مثل K-ras والواصمات السرطانية التقليدية مثل CA-19-9 في زيادة تحسين حساسية وتقصي وتقييم تنامي أورام المستقيم والبنكرياس. إن تطفير جيني الإعاقة السرطانية p53 و BR هو الأكثر شيوعاً في غالبية الأورام، مما هو عليه تطفير الجينات السرطانية المسؤولة عن هذه الأورام ذاتها.
يُظهر الجدول 2 الجينات السرطانية التي يمكن أن تكون ذات أهمية في مجال تطبيقات اختبارات الأورام، كما يمكن تصنيفها إلى عدة فئات حسب وظيفة النشاط النسخيِّ الجيني:
- منظمات الدارة الانقسامية الخلوية؛
- ترميم الدنا.
ويجري حالياً استخدام الرقاقة المكروية في تحليل التعبير الجيني وذلك باستخدام خلايا أو أنسجة. ولقد قام الباحث Saravana وزملاؤه بتحليل آلاف الجينات بهذه التقانة وذلك بغية تحسين تقدم وتصنيف سرطان غدة البروستات. ولقد قاموا باختيار مراحل مختلفة من تنامي الورم وذلك لدى 700 عينة سريرية. ولقد تبين بوساطة هذه التقانة أن تعبير الهيبسين Hepsin والـ pim-1 لهما ارتباط بالأعراض السريرية لمدى تقدم هذا الورم. و لقد قاموا، في دراسة لاحقة، بتحديد هوية معززٍ Enhancer لجنيس/ مثيل زيست-2 Zeste Homologue 2 (EZH2) كأحد أهم الواصمات النوعية المرشحة لسرطان غدة البروستات وذلك بالعلاقة مع تقدم هذا الورم باتجاه حالة النقائل Metastasis (الانتشار) ومرحلته المميتة. وبالإضافة إلى ذلك، فإن تحليل التعبير الجيني للأورام الصلبة والنقائل قد أظهر مجموعة جينات مرتبطة بالنقائل وأن الخلايا المنتقلة موجودة في الأورام الأولية. كما جرى تحديد البروستاسين Prostasin كأحد أهم الواصمات المصلية لسرطان المبيض الذي جرى تحديده بتقانة الرقاقة المكروية. ولذلك فإن هذه التقانة مفيدة في مجال كشف واصمات جديدة. وعلى الرغم من تعقيدات هذه التقانة إلاّ أنها تقدم أدلة قاطعة ويجب استخدامها مترافقةً مع التشخيص المرضي.
يمكن مقارنة الطفرات الجسـدية الدّالة على عدم ثبات التوابع الدقيقة بالميقاتية البيولوجيـة الدالـة على انقسامات الخلايا السرطانية وذلك عبر تبدلات في تنوعها. وأظهرت التقارير الراهنة أن كشف تنوع التوابع الدقيقة، حتى في مصل مرضى السرطان، ممكن باستخدام تفاعل سلسلة البوليميراز PCR وذلك عبر تضخيمها. لقد جرى كشف وتقصي طفرات التوابع الدقيقة في المصل بنسبة 71% من المرضى ذوي سرطان خلوي رئوي صغير. وكذلك أيضاً في حالات سرطان القولون والرأس والرقبة. وفي حالات أخرى فإن تحليل عدم ثبات DNA التوابع الدقيقة في المصل، قد أدى إلى كشف 71% من سرطانات الكبد وخاصة الذين لديهم الواصم ألفا- فيتوبروتين دون القيمة الحدية، وهنا بلغ مستوى إجمالي الحساسية لسرطان الكبد 100% وبلغت نوعية الاختبار نسبة 81%، ولقد تحقق ذلك عبر استخدام 19 واصم للدنا. وهكذا، فإن عدم ثبات التوابع الدقيقة هو مؤشرٌ نوعيٌّ حيويٌّ مصليٌّ لأورام نوعية لا تعود لأعضاء Non-organ، مما يسمح بكشفٍ مُبْكِرٍ لتفاعلاتٍ سرطانيةٍ في الجسم. كما أنه جرى كشف نشاط إنزيم التيلوميراز بنسبة تزيد عن 90% من سرطانات الإنسان، وذلك عبر تحليل الأنسجة وتحليل الخلايا المنشئة. ولكن ليس في الأنسجة الطبيعية المجاورة للورم، وثبت أنها مرتبطة بسلوكٍ سرطانيٍّ أكثر شراسة.
يُقاسُ نشاط إنزيم التيلوميراز عبر خطوات تضخيم مكررات النهايات الطرفية للصبغيات، ولقد وجد نشاط إيجابيٌّ بنسبة 81% من سرطان القولون و70% من سرطان المعدة. ولقد دلت دراسة أخرى على كشفٍ إيجابيٍّ لنشاط إنزيم التيلوميراز بلغت نسبته 93% لدى مرضى سرطان الثدي؛ ولقد شمل ذلك نسبة 68% من الأورام الأولية و95% من مرحلة الورم المتقدم، من خلال عينات اسئصلت جراحياً. ولقد أثبتت تقارير عديدة أهمية كشف نشاط إنزيم التيلوميراز في سرطانات مختلفة، خاصة في سوائل الجسم مثل: سائل الحبن Ascites وغُسالة القصبات التنفسية والبول. ولقد دل تحليل نشاط هذا الإنزيم على سرطان المثانة بنسبة 94.5% وذلك عبر تحليل سائل غسل المثانة، إلاّ أن حساسية ونوعية التحري كانت أعلى وذلك مقارنةً مع الواصمات السرطانية المصلية.
|
 |
| 3. اختبار علم الصيدلة الجينومي في السرطان من أجل الأدوية الهدفية
Pharmacogenomic testing of cancer for targeting drugs
|
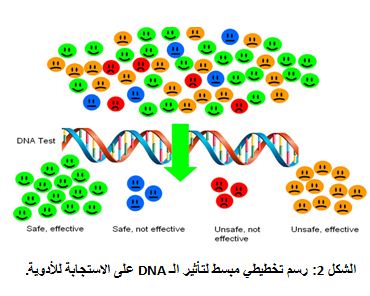
| يُتوقع أن تقود التطورات الراهنة في مجال علم الصيدلة الجينومي إلى علاج سرطاني هدفي عبر استخدام جزيئات نوعية تجاه سرطانات محددة. تعد الأدوية الهدفية علاجاً صحيحاً وتمنح تحصيناً وكلفتها منخفضةً، مقارنة بالأدوية التقليدية في هذا المجال. وتكفل هذه الأدوية أن جرعة مثلى من الدواء المناسب، التي ستعطى للمريض المناسب، ستتمثل بتأثيرات جانبية منخفضة. ويحتاج كل دواء سرطاني هدفي إلى اختبار نوعيّ لتحديد الخلفية الجينومية للمريض بشأن استجابته للعقار وذلك قبل تنفيذ تطبيق الجرعة الدوائية (الشكل 2). فعلى سبيل المثال: إن عقار الهيرسيبتين Herceptin، المضاد لسرطان الثدي والمتوفر حالياً للاستخدام، هو مقيد الاستخدام لمرضى لديهم فرط في تعبير HER-2/neu. فالمرضى الذين لديهم هذه الحالة الجينية يملكون مستقبلاً نوعيٌّاً ويمثلون نسبة 20% من مرضى سرطان الثدي، ويجب تفريقهم عن المرضى الآخرين وذلك بغية العلاج. ولقد سمحت الـ FDA باستخدام عقار Gleevec، مثبط نوعي لإنزيم تيروزين كيناز لجين Bcr-Abl، وتبلغ نسبة فعاليته 90% في المراحل المبكرة من الابيضاض النقوي المزمن Chronic Myelogenous Leukemia (CML) الناجم عن نشاطٍ غير طبيعي لهذه الجين الاندماجية بفعل انتقال صبغي عكوس بين الصبغي-9 والصبغي-22. ويعد عقار إريزا Eressa مثبطاً نوعياً لإنزيم تيروزين كيناز في علاج سرطان خلايا الرئة غير الصغيرة في اليابان. |
| 4. أثر التشخيص التصويريّ على السرطان في علاقته مع الواصمات الورمية
Impact of imaging diagnostic on cancer in relation to tumor markers
|
لقد تطورت وتحسنت الواصمات الحيوية السرطانية مع الزمن وذلك بالعلاقة مع أهداف تتعلق بتطور الأورام ومراقبتها علاجياً. إلا أن عملية كشف الأورام المبكرة والقدرة على تحليل مخاطر الإصابة أو تطور الأورام، لم ترقَ بعد إلى مستويات مناسبة للتطبيقات السريرية. لكن التقانات التصويرية غير الخزعية قدمت، خلال العقدين المنصرمين، تطورات هامة جداً في مجال تشخيص السرطان وذلك باستخدام تقانات محوسبة، وذلك ليس فقط في مجال التطبيقات السريرية بل أيضاً في سياق البحث العلميّ. وعلى سبيل المثال في سرطان الرئة، إن تشخيصه بالواصمات التقليدية يعني أنه بلغ مرحلة النقائل Metastasis أو بوساطة التحليل الخلوي للقشع. لقد طُبِّقَ التقصيّ الكتلي Mass Screening (CT) لكشف سرطان الرئة على 5483 مريضاً في اليابان، باستخدام التصوير اللولبيّ منخفض الجرعة بأشعة-X بوساطة وحدة متنقلة. ولقد دلت الدراسة أن معدل الكشف بهذه التقانة بلغ 0.48%، بما فيها أورام قطرها أقل من 10 ملم، في حين أن معدل الكشف بتقانة التقصيّ الكتلي التقليدي بلغت 0.03-0.05%، مما يدل على قصورٍ في الكشف بلغ عشرة أضعافٍ. كما تُفيد هذه التقانة في تمييز تحت أنواع صغيرة من سرطان الرئة المحيطيّ الغدي Adenocarcinomas. لقد طبق التَّصْويرُ بالرَّنينِ المِغْناطيسِيّ magnetic resonance (MRI) imaging في مراحل سبقت العمل الجراحي وذلك لتمييز المناطق التي يجب استئصالها Discriminate Resectability. أظهرت نتائج تقانة الـ MRI دقة صحيحةً بلغت نسبة حساسيتها 98% ونوعيتها 92% وذلك لدى مرضى سرطان البنكرياس. وتستخدم هذه التقانة، التي لا تزال تتطور وتتحسن قدراتها، في تشخيص وعلاج غدة البروستات، وكذلك الحال باستخدام التنظير الضوئي في سرطان القولون والمستقيم والمعدة. ولقد طُورت تقانة حديثة وهي التصوير المقطعي البصري الترابطي المنطقي Optical Coherence Tomography (OCT) المتآزرة مع التصوير الضوئي بالألياف البصرية وذلك لتمييز الأورام الخبيثة المسطحة Flat Malignant من الآفات الالتهابية Inflammatory lesions. لقد استخدم التصوير المقطعي بتَخْطيطُ الصَّدَى (بالأمواج فوق الصوتية) كمسار فحص ثانٍ، إلى جانب الفحص بالواصم CA-125، وذلك لرفع نسبة حساسية كشف سرطان المبيض، وهذا الأمر مشابهٌ لكشف التدمي في البراز مع كشف سرطان المستقيم بوساطة التنظير الضوئـي. لقد ساهم التَّصْويرُ المَقْطِعِيُّ بالإِصْـدارِ البُوزِيتْرُونِيّ Positron Emission Tomography (PET)، الذي يولد صوراً عبر كشف إشعاعات صادرة من جزيئات قائِفَة Tracer Molecules، في تحسين كفاءة الحساسية في الكشف والتقصي. وإن تطبيقاته لا تزال قيد التوسع خاصة عبر تطوير قوائف جزيئية نوعية الهدف. وهنالك توجه نحو قوائف جزيئية جينية لاستقصاء التعبير الجيني في نماذج حيوانية مخبرية. لقد استخدمت تقانة PET في تجارب العلاج الجيني في حالة التعبير الجيني لـ HSV1-tk وذلك باستخدام بديل الثيميدين المسمى FIAU الموسوم بنظيرٍ مشع.
لقد امتلكت تقانات التصوير المقطعي مكانة بارزة في تشخيص الأورام وذلك بالتآزر مع الواصمات الحيوية والجزيئية في المصل والأنسجة. وإن التطورات في مجال التصوير المقطعي بأشكاله المختلفة سوف تؤدي بالضرورة إلى خفض نفقات التشخيص وبالتالي العلاج وذلك مترافق مع مكسب الدقة الفائقة في الكشف والتشخيص. وبناءً على ذلك، فإنه وبغض النظر عن تطوير الواصمات الجزيئية، فهي ستخدم كأداة متممة للتشخيص المقطعي في المستقبل القريب. ويعد تطوير واصمات متآزرة مع التصوير المقطعي هدفاً منشوداً في مجال التشخيص بالتصوير المقطعيّ، في مجال كشف وتشخيص الأورام المختلفة وتحديد مراحل تطورها ومدى وخامتها.
|
| 5. الملخص Summary |
1. هناك حاجة لتطوير واصمات سرطانية مصلية تتخطى قصورات الواصمات الراهنة، وذلك لضرورة التقصي والتفريق بين مراحل تنامي الورم ونوعيته وأيضاً الكشف النوعي المتخصص في عضوٍ جسديٍّ محدد.
2. مقارنة بالواصمـات الحيويـة، فإن الجينـات
السرطانية/ والجينات الكابتة ليست نوعيةً جداً لسرطانات الخلايا الجسدية، وذلك على الرغم من كونها ستصبح المسار الاعتيادي في تشخيص الأورام.
3. هنالك حاجة إلى مزيد من الدراسات حول كبت الجينات الكابتة بفعل المثيلة، في مناطق عدم ثبات التوابع الدقيقة في المِعْزازات Promoters الجينية، وذلك بغية تطبيقها كواصمات واسعة الطيف للكشف المبكر عن الأورام.
4. يعد نشاط إنزيم التيلوميراز المرمم للنهايات الصبغية التيلوميرية/ الطرفية في الخلايا السرطانية الجسمية وعلاقته بوخامة السرطان من الواصمات النوعية الغالبة. ولقد وجد أن قياس نشاط الإنزيم، بالاعتماد على قياس تكرارات النُوكْلِيُوتيدات التيلوميرية كمؤشر نسبيّ، قد بلغ نسبة تزيد عن 90% في الأنسجة السرطانية الصلبة وسوائل الجسم. وإذا تحقق تقدم في قياس نشاط هذا الإنزيم، فإنه بالإمكان استخدام المصل كعينة تحليلية بدل النسج.
5. بالإمكان استخدام تحليل نشاط إنزيم التيلوميراز بالتآزر مع التصوير المقطعي في التقصي الروتيني عن السرطان.
6. يعد علم الأدوية الجينومي، في ما يخص الأدوية الهدفية ضد الأورام، من التقانات الواعدة في مجال التشخيص. وهنالك حاجة ماسّة للتحليل والتقصي الجزيئي قبل البدء بتطبيق العلاج بالأدوية الهدفية، وذلك ضروريٌّ من أجل تحديد الجرعة الفعالة ومدى القابلية الجينية للمريض لذلك العقار، وذلك توخياً لتقليل الأعراض الجانبية إلى حدها الأدنى.
7. لقد تطورت تقانات التصوير المقطعي المحوسب بشكل مذهلٍ. فلقد أضحت هذه التقانات قادرة على تقصي ورم قطره 10 ملم وتحديد موقعه.
8. سوف تختفي/تزول الواصمات التقليدية قريباً، وتعد الواصمات الحيوية الجديدة والقوائف وسيلة أولية للتحليل، حتى قبل البدء بالتصوير المقطعيّ.
9. سيكون التصوير المقطعي المتآزر مع الواصمات الحيوية والقوائف النوعية هدفاً منشوداً في التقصي المبكر للسرطان.
10. يعد التشخيص في المختبر in vitro بوساطة الواصمات الحيوية، وليس بوساطة تقانة التصوير الطبقي، الوحيد القادر على التنبوء باختطار السرطان قبل بدئه.
|
| |
| |
