| المجلد 6 ,
العدد 5
, جمادى الأولى 1433 - نيسان (أبريل) 2012 |
| |
| عزل الجراثيم الهوائية من لُب اللوزتين عند الأطفال المصابين بالتهاب لوزتين متكرر ودراسة حساسيتها للمضادات الحيوية |
| Isolation of Aerobic Bacteria from Tonsil’s Core in Children with Recurrent Tonsillitis and Studies its Antibiotic Susceptibility |
| د. عبد الغني كدو و د. مصطفى العموري |
| Abdelghani Keddo and Mustafa Al-Amori |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University. |
| الملخص Abstract |
| يعد التهاب اللوزتين الراجع العدوى الأشيع في الطفولة، إذ تفشل فيه المعالجة بمُضادُّات المِكروبات وغالباً ما يحدث النكس. لذلك هدفنا في دراستنا إلى عزل واستعراف الجراثيم الهوائية المتوضعة في لب اللوزتين لدى أطفال مصابين بالتهاب اللوزتين الراجع ودراسة حساسيتها للمضادات الحيوية. جُمعت نماذج من لب لوزات 80 مريضاً، تراوحت أعمارهم بين 5-12 عاماً، يعانون من التهاب لوزتين راجع وأُجريت لهم عملية استئصال اللوزتين. أجري استعراف الجراثيم الهوائية وحساسيتها للمضادات المكروبية (الأدوية) حسب الطرق المعيارية. وأظهرت النماذج جميعها نمواً جرثومياً. وكانت الجراثيم إيجابية الغرام هي الأكثر تواتراً (83.49%)، متضمنة العُنْقودِيَّات الذَّهَبِيَّة (40%)، العُنْقودِيَّات البَشْرَوِيَّة (26.95%)، فالعِقْدِيَّات المُقَيِّحَة (16.52%). أما الجراثيم سلبية الغرام فكانت بنسبة 16.51%، متضمنة الكلِبْسيلَّةُ الرِّئَوِيَّة (10.43%) والإِشْريكِيَّةُ القولونِيَّة (6.08%). كانت معظم الذراري إيجابية الغرام حساسة لكلٍ من الإيميبينيم والأوغمنتين والسيفروكسيم والسيفبروزيل والأميكاسين، في حين كانت معظم سلبيات الغرام حساسة لكلٍ من الإيميبينيم والأوغمنتين والأميكاسين. |
Recurrent tonsillitis is the most common infection in childhood, antimicrobial therapy failure and relapse often occurs. In our study we aimed to isolate and identify the aerobic bacteria located in tonsil’s core in children with recurrent tonsillitis and study its susceptibility to antibiotics.
Specimens were collected from the tonsil’s core of 80 patients, their ages ranging from 5-12 years, suffering from recurrent tonsillitis and undergoing tonsillectomy. Aerobic bacterial identification and antimicrobial susceptibility were carried out through standard procedures. All specimens shows bacterial growth .The Gram Positive bacteria were most frequent (83.49%), including Staphylococcus aureus (40%), Staphylococcus epidermidis (26.95%), Streptococcus pyogenes (16.52%). Gram negative bacteria were 16.51%, including Klebsiella pneumonia (10.43%), and Escherichia coli (6.08%). Most Gram Positive strains were sensitive to Imepinem, Augmentin, Cefruxim, Cefprozil, and Amikacin, while most Gram Negative was sensitive to Imepinem, Augmentin, and Amikacin.
|
| المقدمة Introduction |
| يُعدُّ مرض التهاب اللوزتين من الأمراض الأكثر شيوعاً عند الأطفال بعمر 5-12 عاماً (10، 13، 48، 54). ويظهر هذا المرض بشكلين، حاد acute، يحدث عند الإصابة الأولية بالجراثيم المُمرِضة، ومُزمن chronic أو راجع recurrent، يحدث عند فشل المعالجة وتكرار الإصابات الحادة لأكثر من ست مرات بالسنة (6، 8، 18، 38). وفي حال عدم تماثل المريض للشفاء، على الرغم من استخدام المعالجة المُكثفة بالمضادات الحيوية، فإن الأطباء يفضلون استئصال اللوزتين (9، 15، 20، 29، 44، 53)، لأنهما تصبحان مستودعاً لجراثيم تكون غالباً مقاومة للعديد من المضادات الحيوية المستخدمة في المعالجة (7، 17، 19، 21، 34، 42، 52). ويؤدي تكرار الإصابة، في بعض الحالات، إلى عواقب وخيمة مثل حُمَّى الرُّوماتزم الحادة Acute rheumatic fever، و الحُمَّى القِرْمِزِيَّة Scarlet fever، والتهاب كُبَيباتِ الكُلَى Glomerulonephritis (4، 5، 45). يُشخص المرض عادة بالقصة المرضية والفحص السريري، وبزراعة مسحة من سطح اللوزتين لعزل الجراثيم منها وتحديد حساسيتها للمضادات الحيوية (3، 32، 40، 43، 49). ولكن هذه الآلية، في أغلب الحالات، لا تؤدي إلى تحسن سريري واضح. وغالباً ما تحدث حالات نَكس relapse عند إيقاف المعالجة (11، 16، 22، 23، 37، 39، 46، 50، 51)، مما عزز الاعتقاد بعدم قدرة المضاد الحيوي على استئصال العدوى (25، 32، 40، 47). ومن هنا جاء التشكيك في القيمة التشخيصية لمسحة سطح اللوزتين، في تحديد الجراثيم الممرضة المسؤولة عن العدوى (1، 2، 47). ونتيجة لذلك، أخذت الأبحاث في التركيز على دراسة المحتوى الجرثومي للُّب اللوزتين (24، 26، 33، 56). وعلى الرغم من النتائج الهامة، فإن أنواع ونِسب الجراثيم المعزولة لا تزال مَوضع جدل (14، 35، 36). فقد أشارت عدة دراسات (27، 30، 31، 35) إلى أن المكورات إيجابية الغرام هي الأكثر عزلاً في التهاب اللوزتين الجرثومي الراجع، حيث كانت العُنْقودِيَّات الذَّهَبِيَّة Staphylococcus aureus في المرتبة الأولى، تلتها العقديات المقيحة. ولكن بالمقابل أشارت بعض الدراسات (12، 14) إلى أن العِقْدِيَّات المُقَيِّحَة Streptococcus pyogenes هي الأكثر عزلاً من بين إيجابيات الغرام. غير أن دراسات أخرى (13، 36) بينت أن العصيات سلبية الغرام كانت الأكثر عزلاً وبشكل خاص المستدميات النزلية Hemophilus influenza ، أما تواتر الكلِبْسيلَّةُ الرِّئَوِيَّة Klebsiella pneumonia والإشريكية القولونية Escherichia coli من العصيات سلبية الغرام فلقد كان قليلاً في معظم الدراسات (1، 2، 30، 31، 35). ومن هنا جاءت دراستنا لتعين الجراثيم الهوائية الأكثر تواتراً داخل لُب اللوزتين، عند مرضى التهاب اللوزتين الراجع الذين يراجعون مستشفياتٍ في مدينة دمشق وريفها. ومن ثم معرفة المضادات الحيوية الأكثر فعالية على تلك الجراثيم، في خطوة لمساعدة الأطباء في انتقاء المضاد الحيوي المناسب عند المعالجة التجربية للمريض. |
| المواد والطرقMaterials and Methods |
شملت دراستنا 80 طفلاً (أعمارهم بين 5-12 عاماً)، شُخص لديهم التهاب لوزتين جرثومي راجع، وأُجريت لهم عملية استئصال اللوزتين في مستشفيات المواساة الجامعي وحرستا الوطني ومستشفيات خاصة في مدينة دمشق وريفها. أُخذت العينات من لب اللوزة بعد تعقيم سطحها بمحلول البوفيدون اليودي 4% كي لا تدخل الجراثيم الموجودة على السطح ضمن الدراسة. بعد ذلك شُقت إحدى اللوزتين بوساطة مشرط مُعقم، وأخذنا مسحة من داخل خبايا اللوزتين من المنطقة الحاوية على قيح، ثم زرعت على وسط سائل مغذٍ بهدف تكثير عدد الجراثيم بدرجة حرارة °37م لمدة 24 ساعة، ومن المعلق الجرثومي الناتج قمنا باستفراد وعزل الذراري الجرثومية بالطرق المعيارية لذلك، ثم اُستعرفت الجراثيم المعزولة تبعاً للطرق المعيارية.
استخدمنا المستنبتات التالية : المرق المغذي Nutrient Broth، ومرق موللر هينتون Muller Hinton Broth، والآغار المغذي Nutrient Agar، وآغار موللر هينتون Muller Hinton agar، ومستنبت أساس الآغار بالدم Blood agar base، ومستنبت آغار شوكولا Chocolate agar، ومستنبت شابمان Manitol Agar Salt، والآغار بالأيوزين وزرقة الميثيلينEMB Agar، وجميعها من شركة Biomêrieux (فرنسا).
جرت دراسة حساسية الجراثيم للمضادات الحيوية بطريقة Kirby Bauer باخْتِبارُ تَفَشِّي القُرْص Disk diffusion test (41، 55) واستخدمنا لذلك المضادات الحيوية التالية:
الأموكسيسيلين/ حمض الكلافولانيك Amoxicillin/clavulanic acid, (AUG 30mcg,)، والأموكسيسيلين Amoxicillin AMX) 30mcg,)، والأوكساسيللين Oxacillin (1mcg, OXC)، والبيبراسيلين Pipracillin PIP) 100mcg,)، والسيفوروكسيم Cefuroxime 30mcg, CRX))، والسيفبروزيل Cefprozil (CFO mcg,10)، والسيفاكلور Cefaclor CCL) 30mcg,)، والسيفتازيديم Ceftazidime 30mcg, CAZ))، والسيفوتاكسيم Cefotaxime (30mcg, CTX)، والسيفيبيمCefepime 30mcg, CFP))، والسيفازولينCefazolin 30mcg, CZL))، والسيفترياكسون Ceftriaxone 30mcg, CTR))، والأميكاسينAmikacin 30mcg, AMK))، واللينكوميسين Lincomycin mcg, LIN)2)، والأزيثرومايسين Azithromycin 15mcg, AZM))، والكلاريثروميسين Clarithromycin (15 mcg, CLM)، والأريتروميسين Erythromycin (15mcg, ERY)، والتيكارسيللين Ticarcillin (TIC 75mcg,)، والتريميتوبريم/ سلفاميثوكسازول Trimethoprim\Sulphamethoxazole (25 mcg, COT)، والإيميبينيم Imepinem (10 mcg, IMP). وجميعها من شركة Abtek إنكلترا.
|
| النتائج Result |
| أ- نتائج اختبارات العزل والاستعراف |
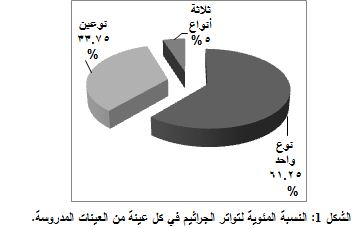
جرى عزل 115 ذرية جرثومية من 80 عينة، حيث كانت كل العينات إيجابية الزرع الجرثومي. وكان عدد العينات التي أعطت نمواً لنوع جرثومي واحد هو 49 عينة (61.25%)، أما التي أعطت نمواً لنوعين من الجراثيم فكانت 27 عينة (33.75%). في حين أعطت 4 عينات فقط (5%) نمواً لثلاثة أنواع جرثومية، كما هو مبين في الشكل 1.
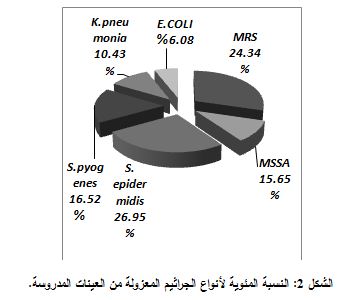
أما من حيث أنواع الجراثيم المعزولة فكانت الجراثيم إيجابيات الغرام هي السائدة (83.49%) وتوزعت بين العنقوديات الذهبية (40%)، والعنقوديات البشروية (26.95%)، فالعقديات المقيحة (16.52%). أما الجراثيم سلبية الغرام فقد شكلت 16.51% من مجمل الذراري المعزولة وضمت الكلبسيلة الرئوية (10.43%) والإشريكية القولونية (6.08%)، كما هومبين في الشكل 2.
|
|
ب- نتائج اختبارات التحسس للمضادات الحيوية
جرت اختبارات التحسس بطريقة اخْتِبارُ تَفَشِّي القُرْص، وبعد الرجوع للجداول التفسيرية التي تحدد مدى تحسس الجرثوم تجاه المضاد الحيوي حسب قطر هالة عدم النمو الحاصلة جرى تصنيف الجرثوم إلى حساس أومتوسط الحساسية أو مقاوم وكانت النتائج على الشكل التالي:
1- المكورات العنقودية الذهبية
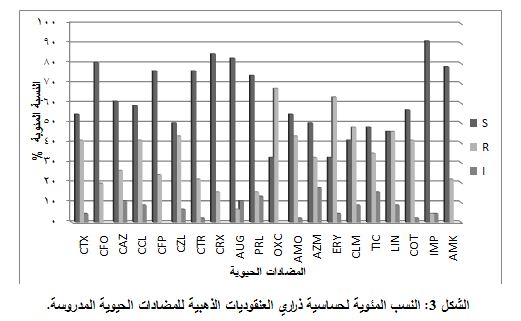
كان الإيميبينيم هو الأفضل، حيث كانت نسبة الذراري الحساسة له 91.30%، تلاه السيفروكسيم (84.78%)، ثم الأوغمنتين (82.6%)، فالسيفبروزيل (80.43%).
وتراوحت نسبة الحساسية بين 54.34% و76.08% لكلِ من السيفترياكسون والأميكاسين والسيفيبيم والبيبراسيلين والسيفتازيديم والسيفاكلور والسلفاميثوكسازول/ تريميتوبريم والأموكسيسيلين والسيفوتاكسيم. أما المضادات التي كانت فعاليتها أقل من 50% فهي السيفازولين والأزيثرومايسين والتيكارسيلين واللينكوميسين والكلاريتروميسين، والمضادات التي أعطت فعالية أقل من 40% هي الأريثروميسين والأوكساسيلين، كما هومبين في الشكل 3.
2- العنقوديات البشروية
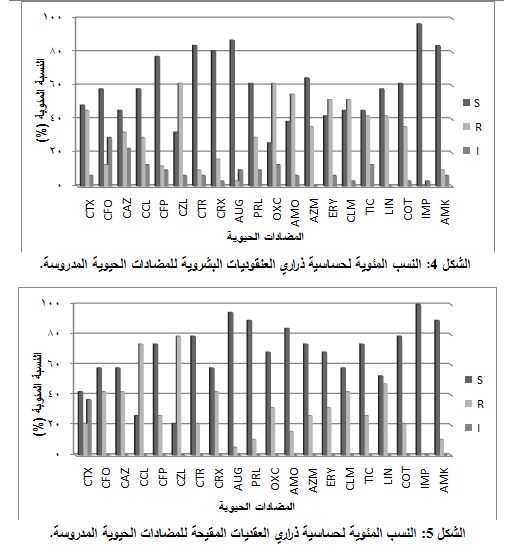
كذلك كان الإيميبينيم (96.77%) هو الأفضل، فالأوغمنتين (87.09%)، ثم السيفترياكسون (83.97%) والأميكاسين (83.87%). وكان أكثر من 50% من الذراري حساسة لكل من السيفروكسيم والسيفيبيم والأزيثرومايسين والبيبراسيلين والسلفاميتوكسازول/ تريميثوبريم والسيفبروزيل والسيفاكلور واللينكوميسين. بينما كانت نسبة الذراري المقاومة أكثر من 50% للصادات التالية : السيفتازيديم والكلاريتروميسين والتيكارسيلين والسيفوتاكسيم والأريتروميسين والأموكسيسيلين والسيفازولين، وجاء الأوكساسيلين بأقل نسبة تحسس 25.8%، كما هو مبين بالشكل 4.
3- العقديات المقيحة
كانت كل الذراري حساسة للإيميبينيم (100%)، وبنسبة أقل للأوغمنتين (94.73%)، فالبيبراسيلين والأميكاسين (89.47%)، ثم الأموكسيسيلين (84.21%). وكانت نسب الحساسية بين 52.63% و78.94% لكلٍ من السيفترياكسون والسلفاميتوكسازول/ تريميثوبريم والسيفيبيم والأزيثرومايسين والتيكارسيلين والأوكساسيلين والأريثروميسين والسـيفبروزيل والسـيفتازيديم
والسيفروكسيم والكلاريثروميسين. وكانت نسبة الحساسية أقل من 50% للمضادات التالية: اللينكوميسين والسيفوتاكسيم والسيفاكلور والسيفازولين، كما هومبين في الشكل 5.
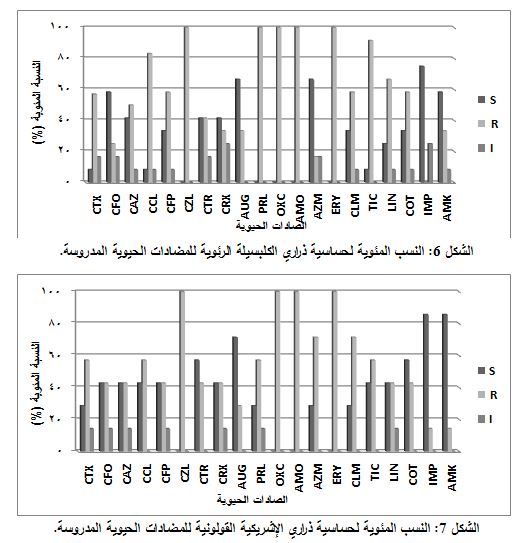
4- الكلبسيلة الرئوية
وجدت دراستنا أن أعلى نسبة للحسـاسـية هي
للإيميبينيم (75%) ثم الأوغمنتين فالأزيثرومايسين (66.6%)، ثم السيفبروزيل فالأميكاسين (58.3%)، والمضادات التي أعطت فعالية أقل من 50% هي: السيفتازيديم والسيفروكسيم والسيفترياكسون (41.6%) ثم السيفيبيم والكلاريتروميسين والسلفاميتوكسازول / تريميثوبريم (33.3%)، فاللينكوميسين (25%) والسيفاكلور والتيكارسيلين (8.3%)، وكانت نسبة المقاومة 100% على كلٍ من السيفازولين والأموكسيسيلين والأوكساسيلين والبيبراسيلين والأريثروميسين، كما هومبين في الشكل 6.
5- الإشريكية القولونية
وجدنا أن أعلى فعالية هي للإيميبينيم والأميكاسين (85.7%)، فالأوغمنتين (71.4%)، ثم السيفترياكسون والسلفاميتوكسازول/ التريميثوبريم
(57%)، وكانت الفعالية أقـل من 50% على السيفبروزيل والسيفتازيديم السيفاكلور والسيفيبيم والسيفروكسيم والتيكارسيلين واللينكوميسين (42.2%) والبيبراسيلين والكلاريثروميسين والأزيثرومايسين (28.5%)، وكانت نسبة المقاومة 100% على السيفازولين والأموكسيسيلين والأوكساسيلين والأريثروميسين، كما هومبين في الشكل 7.
|
|
| المناقشة Discussion |
لقد وجدنا في دراستنا أن غالبية الجراثيم المعزولة هي من إيجابيات الغرام (83.49%)، حيث جاءت العنقوديات الذهبية بالمرتبة الأولى (40%)، تلتها العقديات المقيحة (16.52%)، و توافق هذا مع دراسات عديدة أُجريت في مناطق مختلفة من العالم (1، 2، 27، 30، 31، 35). لكن وفي دراسات عالمية أخرى (3، 12، 14) كانت العقديات المقيحة هي الأكثر تواتراً وكان هذا مخالفاً لنتائجنا، ويُعزى هذا الاختلاف إلى طرق العلاج المتبعة في بلادنا والتي تعتمد في غالبيتها على العلاج التكهني واستخدام مضادات معينة (كزمرة البنسلينات)، ذات الفعالية الجيدة على العقديات المقيحة ولكنها قليلة التأثير على العنقوديات المفرزة لإنزيم البيتالاكتاماز. كما أن هنالك نتائج أخرى لم تتفق مع نتائجنا، حيث أكد بعض الباحثين (13، 36) أن المستدميات النزلية من سلبيات الغرام هي الأكثر تواتراً في التهاب اللوزتين المتكرر. أما باقي أنواع سلبيات الغرام كالكلبسيلة الرئوية والإشريكية القولونية فكانت نسبتها قليلة في بحثنا، وتوافق هذا مع عدة دراسات أجريت في مناطق مختلفة من العالم (1، 2، 27، 30، 31، 35).
كانت 80% من ذراري العنقوديات حساسة لمضادات من زمرة البيتالاكتام (السيفروكسيم والأوغمنتين والسيفبروزيل)، بينما أبدت حوالي 50% من الذراري مقاومة لكلٍ من الماكروليدات (الأزيثرومايسين والكلاريثروميسين) واللينكوميسين، و توافق هذا مع عدة دراسات (1، 2، 26) أشارت إلى أن فاعلية الأوغمنتين هي حوالي 80-90%، وفعالية الأزيثرومايسين هي حوالي 50-60%.
وفي ما يتعلق بحساسية العقديات المقيحة، كانت حوالي 75%، من الذراري المعزولة في بحثنا، حساسة لمضادات من زمرة البيتالاكتام (السيفروكسيم والأوغمنتين والسيفبروزيل). بينما أبدت 50% من الذراري مقاومة على كلٍ من اللينكوميسين والسيفوتاكسيم والسيفاكلور والسيفازولين و توافق هذا مع دراسات عالمية عديدة (3، 6، 7، 18، 21، 52). أما بالنسبة لحساسية الكلبسيلة الرئوية والإشريكية القولونية فلقد أبدت حوالي 70% من الذراري المعزولة حساسية لكلٍ من والأزيثرومايسين والأوغمنتين والأميكاسين، في حين كانت جميعها مقاومة للسيفازولين واللينكوميسين والأريثروميسين. و توافق هذا مع عدة دراسات عالمية (1، 2، 26). تُعزى الفعالية الجيدة لزمرة البيتالاكتام (الأوغمنتين والسيفروكسيم والسيفبروزيل) إلى طيفها الواسع، بالإضافة إلى امتلاكها حرائك دوائية pharmacokinetics تجعلها تحقق تراكيز في الجسم قادرة على تغطية التركيز الأصغري المثبط لنموالجراثيم (MIC) لفترة زمنية كافية، كما أن الأوغمنتين وبسبب احتوائه على حمض الكلافولانيك يستطيع القضاء على العنقوديات المُفرزة للبيتالاكتاماز. كما أن التزام الأطباء بالجرعات النظامية ومدة العلاج المنصوح بها من هيئات عالمية جعل نسب المقاومة عليه قليلة. كما تعزى الفعالية الجيدة لكلٍ من السيفروكسيم والسيفبروزيل كونهما من المضادات ذات الطيف الواسع الحديثة نسبياً، والتي لا تستعمل بشكل عشوائي من قبل المرضى، مما جعل نسب المقاومة المُسجلة عليها قليلة.
أما نِسب المقاومة العالية على زمرة الماكروليدات (الأزيثرومايسين والكلاريثروميسين) فتُعزى إلى حركيتها الدوائية، حيث أنها تبقى في الجسم بعد انتهاء مدة العلاج بتراكيز أقل من الـتراكيز المُثبطة لنموالجراثيم، الأمر الذي يجعل الجراثيم قادرة على تشكيل مقاومة عليها، كما أنها من المضادات التي تعتمد فعاليتها على تركيزها في الجسم Concentration depending killing. أي أن عدم الالتزام بالجرعات المنصوح بها يؤدي إلى زيادة نسب المقاومة.
|
| التوصيات Recommendation |
1- اعتماد الأوغمنتين والسيفروكسيم والسيفبروزيل كخيارات أولية في المعالجة التكهنية لالتهاب اللوزتين المتكرر.
2- يفضل أخذ رشافة aspiration من لب اللوزتين من أجل الزرع الجرثومي وإجراء اختبارات التحسس.
|
| المراجع References |
1-Abbas E ,Hamouda M, Karameldin M, Ezzat H, Bahader S: Chronic tonsillitis: clinical diagnosis versus laboratory evaluation with its effect on scholastics achievement.
Thesis submitted for partial fulfillment of Ph. D degree in childhoodstudies, Ain Shams University, Institute of postgraduate childhood studies, 1997.
2-Afaf S. Abdulrahman, Laila A. Kholeif, Yasser M. El-Beltagy and Abeer A Eldesouky: Bacteriology of tonsil surface and core in children with chronic tonsillitis and incidence of bacteraemia during tonsillectomy.
EGYPT. J. Med. Lab. Sci; (ESIC), 13, 2, 2004.
3-AL-Yasseri I. K. H. Bacterilogical and Serological study of ?-hemolytic streptococcal throat infections among school children in Najaf govrnorate. (M. Sc. thesis), Kufa university, Iraq, 2005.
4-Astrauskiene D. Efficacy of empirically prescribed amoxicillin and amoxicillin + clavulanic acid in children’s reactive arthritis: a randomised trial. Clin Exp Rheumatol. 21: 515–21, 2003.
5-Astrauskiene D, Bernotiene E, Bytautiene J, Sakalinskas V, Panaviene V, Venaliene J, Lesinskas E. Recurrent tonsillitis and tonsillectomy in juvenile idiopathic arthritis. Scand J Rheumatol. 2008.
6-Baquero F, Garcia-Rodriguez JA, de Lomas JG,Aguilar L. Antimicrobial resistance of 914 betahemolytic streptococci isolated from pharyngeal swabs in Spain: results of a 1-year ,multicenter surveillance study: The Spanish Surveillance Group for Respiratory Pathogens. Antimicrob Agents Chemother. 43: 178-180, 1999.
7-Bingen E, Bidet P, Mihaila-Amrouch L et al. Emergance of Macrolide –Resistant Streptococcus pyogenes strains in French children. J Antimicrob Chemother. 48: 3559-62, 2004
8-Bisno, A. L., Gerber M. A.,. Gwaltney J. M,. Kaplan E. L, and Schwartz .R. H. Diagnosis and management of group A streptococcal pharyngitis :practice guidelines for streptococcal pharyngitis. Clin. Infect. Dis. 35:113–125, 2002.
9-Bond J, Wilson J, Eccles et al. Protocol for north England and Scotland study of tonsillectomy and adenotonsillectomy in children (NE SSTAC). A pragmatic randomized controlled trial comparing surgical intervention with conventional medical treatment in children with recurrent sore throats.
BMC Ear, Nose and Throat Disorders. 6: 13–22, 2006.
10-Brodsky ,L. and Poje ,C.. Tonsillitis ,Tonsillectomy ,and Adenodectomy ,in Head and Neck Surgery-Otolaryngology. Bailey BJ editor. Philadeelphia: Lippincott Williams & Wilkins. 979 -991, 2001 .
11-Brook I and Dohar J. Management of group A beta-haemolytic streptococcal pharyngotonsillitis in children.
J Fam Pract. 55: S1–11. 2006.
12-Brook I and Foote P. Isolation of Methicillin resistant staphylococcus aureus and Streptococcus pyogenes from the surface and core of tonsils in children. International journal of pediatric otorhinolaryngology, 70(12): 2099-102. 2006.
13-Brook I and Gober A,. Increased recovery of Moraxella catarrhalis and Hemophilus influenza in association with group A ?-haemolytic streptococci in healthy children and those with pharyngotonsillitis. Journal of Medical Microbiology, 55: 989-992, 2006.
14-Brook I and Kiran S. Bacteriology of adenoids and tonsils in children with recurrent tonsillitis.
Ann Otol Rhinol Laryngol. 110: 844-848, 2001.
15-Burton MJ; Towler B. and Glasziou P.
Tonsillectomy versus non-surgical treatment for chronic / recurrent acute tonsillitis (Cochrane Review).
The Cochrane Library, Issue1, Oxford. 2003.
16-Capoor MR; Nair D; Deb M. et al.
Resistance to erythromycin and rising penicillin MIC in Streptococcus pyogenes in India.
Japanese J. Infect Dis; 59: 334-6, 2006.
17-Chole RA. and Faddis BT.
Anatomical evidence of microbial biofilms in tonsillar tissues: a possible mechanisms to explain chronicity.
Arch Otolaryngol Head Neck Surg. 129: 634-6, 2003.
18-Ciftci E, Dogru U, Guriz H. et al.
Antibiotic susceptibility of Streptococcus pyogenes strains isolated from throat cultures of children with tonsillopharyngitis.
J Ankara Med Sch; 25: 15-20, 2003.
19-Costeron JW, Stewart PS. and Greenberg EP.
Bacterial biofilms: a common cause of persistent infections.
Science, 284: 1318-22, 1999.
20-Darrow DH. and Siemens C.
Indications for tonsillectomy and adenoidectomy.
Laryngoscope, 112: 6–10, 2002.
21-Ergin C; Ulker D; Haluk G; Ahmed D. and Erdal I.
Antibiotic susceptibility of Streptococcus pyogenes strains isolated from throat cultures of children with tonsillopharyngitis.
Journal of Ankara medical school, 25, 1, 2003.
22-Farid M. and Al Saffar S.
In vitro activity of antibiotics against Gram negative bacilli isolated from patients in intensive care and burns units.
Egyp. J. Med. Microbial, 4(9): 685-691, 2000.
23-Falck G.E; Grahn-Hakansson S.E; Holm K. Roos and Lagergren L.
Tolerance and efficacy of inferring alpha-streptococci in recurrence of streptococcal pharyngotonsillitis: a placebo-controlled study.
Acta Octolaryngol. 119: 944-948, 1999.
24-Gul M; Okur E; Ciragil P; Yildirim I. and Akifkilic M.
The comparison of tonsillar surface and core cultures in recurrent tonsillitis.
Am. J. Otolaryngol, 28(3): 173-6, 2007.
25-Gunnarsson R. K; Holm S. E. and Soderstrom M.
The prevalence of potential pathogenic bacteria in nasopharaygeal samples from individuals with a respiratory tract infection and a sore throat implication for
the diagnosis of pharyngotonsillitis.
Family Practice. 18: 266-271, 2001.
26-Hammoud M; Abdel-Khalek Z; Awad S; Abdel-Aziz M. and fathy M.
Chronic Tonsillitis Bacteriology in Egyptian Children Including Antimicrobial Susceptibility.
Australian Journal of Basic and Applied Sciences, 3(3): 1948-1953, 2009.
27-Jeong J.H; Lee D.W; Ryu R.A; Lee Y.S; Lee S.H; Kang J.O. and Tae K.
Bacteriologic comparison of tonsil core in recurrent tonsillitis and tonsil core hypertrophy.
Laryngoscope, 117(12): 2146-56, 2007.
28-Kim S. and Lee NY.
Epidemiology and Antibiotic Resistance of Group A Streptococcus Isolated from Healthy School Children in Korea.
J Antimicrob Chemother, 54: 447-50, 2004.
29-Kaygusuz I; Godekmerdan A; Karlidag T. et al.
Early stage impacts of tonsillectomy on immune functions of children.
Int J Pediatr Otorhinolaryngol; 67: 1311-5, 2003.
30-Kocaturk S; Demiray T; Incesulu A; Kandirali E; Erkam U. and Mert A.
Comparison of adenoid and tons il core cultures in chronic adenotonsilitis.
Kulak Burun Bogaz ihtis Derg, 10(3): 105-9, 2003.
31-Kumar Abhay, Gupta Vaishali, Chandra Kamiesh, P. Gupta, Varshney Saurabh
Clinico bacteriological evaluation of surface and core microflora in chronic tonsillitis microflora.
Indian Journal of Otolaryngology and Head and Neck, 57(2): 118-20, 2005.
32-Kurien M; Stanis A; Job A; Braham adathan and Thomas K.
Throat swab in the chronic tonsillitis: How reliable and valid is it?
Singapore Med. J. 41 (7): 324-6, 2000.
33-Lidroos R. Bacteriology of the tonsil core in recurrent tonsillitis and tonsillar
hyperplasia - a short review.
Acta Otolaryngol Suppl; 543: 206-8, 2000.
34-Linares J; Pallares R; Alonso T; Perez JL; Ayats J; Gudiol F; Viladrich PF. and Martin R.
Trends in antimicrobial resistance of clinical isolates of Streptococci in Bellvitge Hospital, Barcelona, Spain 1999.
35-Loganthana A; Arumainathan U.D. and Raman R.
Comparative study of bacteriology in re current tonsillitis among children and adults.
Singapore Medical Journal, 47(4): 271-5, 2006.
36-Mahakit P; Moungthong G; Sombulna T. and Chantratchada S.
The correlation of micro-organisms between tonsillar crypt culture and tonsillar culture in chronic Tonsillitis.
J. Medical As. sociation Thia. 88 (l3): 582-810, 2005.
37-Mc Clay JE.
Resistant bacteria in the adenoids.
Arch Otolaryngol Head Neck Surg. 126: 625-629, 2000.
38-Milford C; Infirmary R; Oxford S. and Anuku S.
Tonsillectomy and Adenotoctomy, British Association of Otorhingologists Head & Neck Surgeons. 2003.
39-Motta G; Esposito E; Motta S. et al.
The treatment of acute recurrent pharyngotonsillitis.
Acta Otorhinolaryngol Italy. 26 (Suppl 84): 5-29, 2006.
40-Nandi S, Kumar R, Ray P, et al.
Clinical score card for diagnosis of Group A streptococcal sore throat.
Indian J Paediatr; 69: 471-5, 2002.
41-National Committee for Clinical Laboratory Standards. Performance Standards for Antimicrobial Disk Susceptibility testing.
ed4, M2-A4, NCCL, Villanova, PA, USA, 1991.
42-Osterlund A; Popa R; Nikkila T. et al.
Intracellular reservoir of Streptococcus pyogens in vivo: a possible explanation for recurrent pharyngotonsillitis.
Laryngoscope, 107: 640-7, 1997.
43-Ozturk CE, Yavuz T, Kaya D. and Yucel M.
The Rate of Asymptomatic Throat Carriage of Group A Streptococcus in School Children and Associated ASLO Titers in Duzce Turkey.
Japanese J. Infect Dis; 57: 271-2, 2004.
44-Paradise JL; Bluestone CD; Colborn DK; Bernard BS; Rockette EH. and Kurs-Lasky M.
Tonsillectomy and adenotonsillectomy for recurrent throat infection in moderately affected children.
Pediatrics; 110: 7-15, 2002.
45-Pieringer H; Stuby U. and Biesenbach G.
Patients with rheumatoid arthritis undergoing surgery: How should we deal with antirheumatic treatment?
Semin Arthritis Rheum; 36: 278-86, 2007.
46-Richards W. and Ferdman R.M.
Prolonged morbidity due to delays in the diagnosis and treatment of obstructive sleep apnea in children.
Clinical Pediatrics (Philadelphia) 39 (2) 103-108, 2000.
47-Rijal K; Dhakal N; Shah R; Timilsina S; Mahato P; Thapa S. and Ghimire P.
Antibiotic susceptibility of Group A. Streptococcus isolated from throat swab culture of school children in Pokhara, Nepal.
Nepal Med Coll J; 11(4): 238-240, 2009.
48-Robb PJ. and Little P.
Recurrent pharyngotonsillitis.
BMJ., 334: 909, 2007.
49-Robinson AC; Hanif J; Dumbreck LA. et al.
Throat swabs in chronic tonsillitis: a time-honoured practice best forgotten.
Br. J. Clin Pract; 51: 138-139, 1998.
50-Sharma R; Sharma CL. and Kapoor B.
Antibacterial resistance: current problems and possible solutions.
Indian J Med Sci; 59: 120-9, 2005.
51-Stein CR; Weber DJ. and Kelly M.
Using Hospital antibiogram data to assess regional resistance to antibiotics.
Emerging infectious disease, 8 (2): 211-216, 2003.
52-Tamayo J; Perez-Trallero E; Gomez-Garces JL. et al.
Resistance to macrolides, clindamycin and clarithromycin in Streptococcus pyogenes isolated in Spain during 2004.
J Antimicrob Chemother; 56: 80-2, 2005.
53-Van Staaji BK, van den Akker EH, Rovers MM, Hordijk GJ, Hoes AW. and Schilder AG.
Effectiveness of adenotonsillectomy in children with mild symptoms of throat infections or adenotonsillar hypertrophy: open, randomized controlled trial.
Clin Otolaryngol, 30: 60-3, 2005.
54-Wiatrak BJ. and Woolley AL.
Tonsil and Adenoids: In pediatric Otolaryn gology Head and Neck Surgery.
3rd. edition. Richardson MA (Ed.),
Chales CW et al. (Gen. Eds.) Mosby-year book.
Inc. St. Louis. 12: 188-205, 1998.
55-WHO, Performance standard for antimicrobial susceptibility testing.
NCCLS global informational supplement, 22 (1): 53-56, 2002.
56-Zhang PC, Pang YT, Loh KS, et al.
Comparison of histology between recurrent tonsillitis and tonsillar hypertrophy.
Clin Otolaryngol, 28: 235-9, 2003.
|
| |
| |
| المجلد 6 ,
العدد 5
, جمادى الأولى 1433 - نيسان (أبريل) 2012 |
|
|
|
