| المجلد 6 ,
العدد 5
, جمادى الأولى 1433 - نيسان (أبريل) 2012 |
| |
| دراسة مقارنة لطرق تشخيص داءُ اللِّيشْمانِيَّاتِ الجِلْديّ |
| Comparison Study of Diagnosis Methods of Cutaneous Leishmaniasis |
| د. جمانة المحمود، أ.د. عبدالقادر رحمو، أ.د. محمد معروف |
| Almahomud J; Rahmo A. and Maarouf M. |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University. |
| الملخص Abstract |
الهدف: يجري تشخيص داءُ اللِّيشْمانِيَّاتِ الجِلْديّ (CL) في سورية وفقاً للطرق التقليدية باستخدام الاستعراف المجهري والزرع. وهما الأكثر شيوعاً بسبب نوعيتهما العالية. إلا أنه من ناحية أخرى، ما زالت عدة مساوىء تجعل تطبيقها محدوداً. ومن بينها حساسيتها المنخفضة وفترة الاختبار. ونظراً لأن الأبحاث العالمية أظهرت أن طريقة تضخيم دنا منشأ الحركة kDNA PCR عالية الحساسية والنوعية، لذلك كان هدف بحثنا مقارنة حساسية الفحص المجهري والزرع وkDNA PCR اعتماداً على عينات محلية.
المواد والطرق: أخذت عينات من 70 مريضاً خارجياً يشك بإصابتهم بداءُ اللِّيشْمانِيَّاتِ الجِلْديّ من مراجعي مستشفى الأمراض الجلدية والزهرية الجامعي بدمشق. وفحصت كل عينة من خلال الطرق الثلاث: الفحص المجهري، والزرع، وتضخيم دنا منشأ الحركة kDNA PCR .
النتائج: كانت حساسية الطرق الثلاث المطبقة على الشكل التالي: 72.9% للطاخة المجهرية، 68.6% للزرع، 100% لطريقة kDNA PCR.
الاستنتاج: يبدو أن طريقة kDNA PCR هي الطريقة الأكثر حساسية لتشخيص CL. ولذلك يُنصح بها بشكل خاص في الحالات التي يكون متوقعاً فيها سريرياً عدوى باللَيشمانِيَّة مع نتائج زرع أو فحص مجهري سلبية، أو كليهما معاً.
|
In Syria, cutaneous leishmaniasis (CL) is diagnosed by conventional techniques using microscopic identification and culture. Due to their high specificity, they are widely spread. On the other hand, several drawbacks are still limited their application. Among these are low sensitivity and the length of the test. Since the past world researchs showed that kDNA PCR is highly sensitive and specific, the objective of our research was to compare the sensitivity of microscopic examination, culture and kDNA PCR based on local samples.
Materials and Methods: samples were obtained from 70 of out patients with suspected CL referred to Damascus Dermatology hospital. Each sample was examined through the three methods, microscopic examination, culture and
kDNA PCR.
Results: Sensitivity of the three applied methods were: 72.9% for microscopic smear, 68.6% for culture, 100% for the kDNA-PCR method.
Conclusion: The kDNA-PCR method appear to be the most sensitive method for diagnosing CL. It is therefore especially recommended in the cases where leishmania infection is clinicaly suspected and negative results of microscopy or/and culture are obtaind.
|
| المقدمة Introduction |
يعد داء الليشمانيات مشكلة صحية عالمية عامة، حيث ينتشر في 88 دولة في العالم، وتسجل سنوياً بين 2-1.5 مليون إصابة جديدة، ويقدر عدد الأشخاص المؤهبين للإصابة في العالم بحوالي 350 مليون شخص (1). ينجم هذا الداء عن الإصابة بطفيليات من شعبة الحيوانات الأوالي protozoa، رتبة ذوات منشأ الحركة Kinetoplastedae، وجنس الليشمانية Leishmania. يضم جنس الليشمانية عدة أنواع تنقلها في العالم القديم ذبابة الرمل، التي تنتمي إلى جنس الفواصد Phlebotomus (2، 3). يتظاهر داء الليشمانيات بثلاثة أشكال سريرية هي الداء الحشوي، والداء الجلدي، والداء الجلدي المخاطي. ويصنف داء الليشمانيات الجلدي من بين الأمراض المستوطنة في سوريا (4)، وشاعت تسميته "حبة حلب" بين العامة بسبب انتشاره الواسع في تلك المدينة (5، 6).
يعاني المهتمون بمكافحة داء الليشمانيات، في المناطق التي يستوطن فيها الداء، من صعوبة السيطرة على مخازن الطفيلي والقضاء على الحشرة الناقلة. وبالتالي يكتسب تشخيص المرض في المراحل المبكرة من الإصابة ومتابعة العلاج أهمية كبيرة تسمح أيضاً بالحد من انتشاره. يستوجب ما سبق من الباحثين إيجاد طرق تشخيص وتقييم تتمتع بحساسية ونوعية جيدتين (4،5 ). ولا يزال يعتمد تشخيص داء الليشمانيات الجلدي، في سورية، يعتمد على طرق تقليدية أهمها الفحص المجهري والزرع. لكن وعلى الرغم من النوعية العالية التي تتمتع بها هذه الطرق، إلا أنها تعاني من انخفاض كبير في الحساسية، خاصة في الحالات المزمنة التي ينخفض فيها بشكل كبير عدد الطفيليات الموجود في موضع الإصابة الجلدية 7)). بالإضافة إلى ما سبق تواجه الطرق التقليدية كالزرع صعوبات مثل احتمال تلوث الوسط بالجراثيم والفطور، وصعوبة زرع بعض الأنواع مثل L. braziliensis التي تتطلب أوساطاً غنية مثل وسط Schneider, S Drosophila، والحاجة إلى حضن لزمن طويل للوصول إلى النتيجة (1، 8، 9).
سمحت تقانات البيولوجيا الجزيئية باستخدام عدد من الطرق لتشخيص داء الليشمانيات والتي امتازت بارتفاع حساسيتها مقارنة بحساسية الطرق التقليدية (10، 11). تهدف الدراسة إلى تطبيق طريقة تضخيم دنا منشأ الحركة لتشخيص داء الليشمانيات الجلدي، في عينات محلية أخذت من مدينة دمشق وريفها، ومقارنة هذه الطريقة مع الفحص المجهري والزرع، من حيث الحساسية والسرعة في الانجاز. حيث سمح تطبيق التفاعل السلسلي للبوليميراز PCR، لتضخيم المجال المُصان (120 bp) من الحلقات الصغيرة في منشأ الحركة kDNA minicircles، بالحصول على طريقة تشخيص عالية الحساسية.
|
| المواد والطرق |
العينات
جُمعت 70 عينة سريرية من مراجعي مستشفى الأمراض الجلدية والزهرية بدمشق، الذين يشك بإصابتهم بداء الليشمانيات الجلدي وفقاً للمظاهر السريرية للإصابة الموضعة، وذلك في الفترة الواقعة بين شهر أيلول 2009 وشهر أيلول 2010.
الاعتيان
جرى تنظيف الآفة الجلدية وما حولها بالغول الطبي 70% عدة مرات. ثم أخذ السائل المصلي وقطرات الدم المتحررة نتيجة إدخال النهاية الحادة لمشرط عقيم أو رأس محقنة ضمن قاعدة الإصابة المتوذمة وتحريكه للأمام والخلف أو بحركة دائرية لكي تتحرر الطفيليات. يُسحب السائل المصلي وقطرات الدم بوساطة ممص باستور زجاجي عقيم ويوزع السائل المرتشف إلى ثلاث أجزاء. جزء يوضع على صفيحة زجاجية لعمل لطاخة تلون بتلوين غيمزا من أجل الفحص المجهري، وجزء يزرع في أنبوب زرع يحوي وسط NNN (Novy-mac-Neal-Ncolle)، والجزء المتبقي يوضع في أنبوب ايبندورف بحجم0.5 مل يحوي حوالي150 مكرولتر من دارئة فسفاتية ملحية PBS عقيمة مكونة من 15 mM فسفات ثنائية الصوديوم المائية Na2HPO4.H2O، 1.6 mM فسفات أحادية البوتاسيوم KH2PO4، 2.5 mM كلوريد البوتاسيوم KCl، 140 mM كلوريد الصوديوم NaCl ويحفظ بدرجة حرارة 80-مْ إلى حين عزل الدنا DNA.
|
استخلاص الدنا
تُشطف العينة بـ 1 مل من دارئة PBS، ثلاث مرات، للتخلص من آثار الدم. ثم يُضاف 100 مكرولتر من دارئة TE مكونة من 10 mM Tris-HCl و1 mM EDTA. يوضع المزيج في حمام مائي يغلي لمدة 15 دقيقة، ثم ينبذ بسرعة دوران 1200rpm، ويؤخذ السائل الطافي. يعزل الدنا من الطافي بوساطة عتيدة عمل لعزل الدنا من الدم QIAamp Blood MiniKit، من شركة QIAGEN الألمانية. ولقد جرى اتباع الخطة المعدة لعزل الدنا من خلايا الدم مع إجراء التعديل التالي: استخدام 30 مكرولتر من بروتيناز K تركيزه 40 ng/µl.
التضخيم بالـ PCR
جرى تضخيم المجال المصان من الحلقات الصغيرةminicircles ، في دنا منشأ الحركة، الذي يبلغ طوله 120bp تقريباً، لتشخيص الإصابة بداء الليشمانيات الجلدي، باستخدام البادئتين:
(5'-GTGGGGGAGGGGCGTTCT-3')، (5'ATTTTACACCAACCCCCAGTT-3') من شركة Fermentas, LIFE SCIENCES, Germany. وجرى اتباع الخطة المطبقة من قبل Moaddeb و Behbahani، في عام 2008 مع إجراء بعض التعديلات، حيث بلغ حجم تفاعل التضخيم في دراستنا 50 مكل تحوي 1 µM من كل بادئة، و0.2 mM من dNTPs من شركة Fermentas, LIFE SCIENCE, Germany، وTaq polymerase من شركة GENOMICS) Euroclone) بمقدار 5 وحدات، و mM 1.5 من MgCl2، دارئة الـ PCR بتركيز 1X، ودنا العينة بمقدار 5 مكل. وجرى التضخيم باستخدام جهاز المدور الحراري من شركة Germany- eppendorf بإجراء تمسخ أولي بدرجة حرارة 94مْ لمدة 4 دقائق، يليها 40 دورة تتألف كل دورة من تمسخ بدرجة حرارة 94مْ لمدة دقيقة، ثم التحام بدرجة حرارة 56مْ لمدة دقيقة، ثم استطالة بدرجة حرارة72 مْ لمدة دقيقة، يليها تَطْويل نهائي بدرجة حرارة 72مْ لمدة 5 دقائق.
أجري بعد ذلك رحلان ناتج التضخيم على هلامة الأغاروز بتركيز 2%، ثم جرى تلوين العصابات ببروميد الايثيديوم وإظهارها بالأشعة فوق البنفسجية UV. ولقد استخدم الدنا المعزول من طفيليات مزروعة كشاهد ايجابي، بينما استخدم مزيج الـ PCR الحاوي على الدنا البشري كشاهد سلبي، وجرى تقدير طول الدنا باستخدام سلم دنا مئوي DNA ladder.
الدراسة الاحصائية
اعتبرت العينة إيجابية إذا كانت نتائج الفحص المجهري أو الزرع إيجابية أو كان اختبار الـ kDNA PCR إيجابياً. أما إذا كانت المعايرات الثلاث سلبية فلقد جرى اعتبار العينة سلبية. ثم حُسبت الحساسية Sensitivity والنوعية Specificity والقيمة التنبؤية الإيجابيةpositive predictive values(PPVs)، والقيمة التنبؤية السلبية negative predictive values (NPVs). ولقد جرى حساب كاي مربع X2 لدراسة ما إذا كانت الفروقات بين حساسية طرق التشخيص المطبقة جوهرية وناتجة عن اختلاف حقيقي بين حساسية هذه الطرق، أم أنها ناتجة عن الحظ والصدفة. وحددت قيمة مستوى الدلالة P-value. وتعد الفروقات بين الحساسيات معتداً بها إحصائياً إذا كانت قيمة P-value أصغر من 0.05. واستخدم برنامج Microsoft Excel، وبرنامج SPSS (الإصدار 18.0) لمعالجة البيانات وتحليلها.
|
| النتائج والمناقشة |
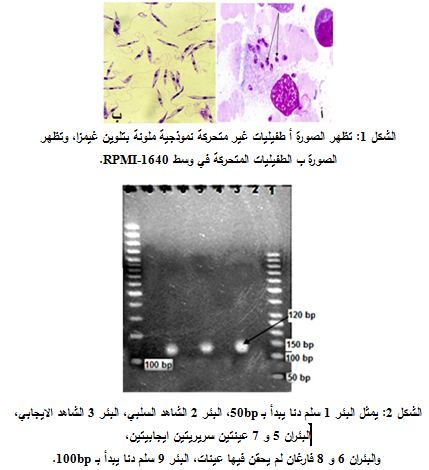
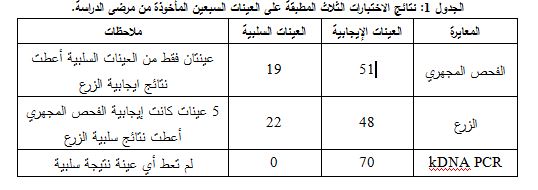
تشكل رؤية الطفيليات غير المتحركة في اللطاخة الملونة بتلوين غيمزا الدليل الوحيد على إيجابية اللطاخة ويستغرق هذا الاختبار مدة تتراوح بين 45-30 دقيقة. وتعتمد إيجابية نتائج الزرع على رؤية الطفيليات المسوطة المتحركة مباشرة بالمجهر المقلوب أو بفحص قطرة عبيطة من وسط الزرع بالمجهر الضوئي على التكبيرين 10x و40x. ولم يحدث اثبات إيجابية الزرع لأي عينة في تجربتنا قبل مضي ثلاثة أيام. هذا ولم يجرِ الجزم بسلبية العينة قبل مضي ثلاثة أسابيع على الزرع (الشكل 1). وكذلك الأمر تعتمد إيجابية نتيجة اختبار kDNA PCR على ظهور عصابة بطول 120bp بعد ترحيل ناتج التضخيم على هلامة الأغاروز 2% (الشكل 2).
هذا ويلخص الجدول 1 نتائج فحص العينات المدروسة وفقاً للطرق الثلاث المستخدمة في هذه الدراسة، حيث جرى إثبات إيجابية كل العينات السبعين.
أظهرت نتائجنا أن عدد العينات الإيجابية بالفحص المباشر هو 51 عينة من أصل 70 عينة. وبالتالي فقد بلغت حساسية الفحص المباشر 72.85%. كما بينت نتائج زرع العينات على وسط NNN أن العينات التي أعطت نتائج إيجابية الزرع كانت 48 عينة من أصل 70عينة. وبالتالي فلقد بلغت حساسية الزرع 68.57%. أظهرت النتائج أن خمس عينات كانت ايجابية بالفحص المباشر وأعطت نتائج سلبية بالزرع. وأن عينتين فقط لم يسمح الفحص المباشر بكشف الطفيليات فيهما، بينما كانت نتائج زرعهما إيجابية. وعليه كان عدد العينات التي تمكن الفحص المجهري و الزرع من اثبات ايجابيتها 53 عينة من أصل 70 عينة مختبرة أي سمحا بتشخيص 75.7% من مجموع العينات. وبما أن الفحص المباشر والزرع يعتمدان على رؤية الطفيليات تحت المجهر لذلك فإن نوعيتهما 100%. هذا وكانت القيمة االتنبؤية الإيجابية للفحص المباشر والزرع والـ kDNA-PCR مساوية 100%، بينما كانت
القيمة التنبؤية
السلبية لهذين الاختبارين 57.85% و 59.32%، على الترتيب.
وكانت نتائج حساسية الفحص المباشر والزرع التي حصلنا عليها متقاربة مع نتائج دراسات Bensoussan وزملائه عام 2006، حيث وجدوا أن حساسية الفحص المباشر والزرع 74.4% و62.8%، على الترتيب. وذلك على عينات لآفات ناجمة عن اللَيشمانِيَّة المدارية واللَيشمانِيَّة الكبرى. هذا وكانت الحساسية المسجلة في دراستنا أعلى من تلك المسجلة في دراسة Kumar وزملائه عام 2007، حيث بلغت حساسية الفحص المباشر والزرع 65.6% و48.2%، على الترتيب. وذلك لعينات من آفات جلدية ناجمة عن أنواع اللَيشمانِيَّة المدارية L. tropica، وأعلى من تلك التي حصلت عليها Christina وزملائها عام 2006، حيث كانت حساسية الفحص المباشر والزرع 52% و34%، على الترتيب. وذلك لعينات من آفات جلدية ناجمة عن أنواع L.viannia.
نستنتج مما سبق أنه على الرغم من أن طرق الفحص المجهري والزرع تشكل المعيار الذهبي في تشخيص داء الليشمانيات الجلدي، خاصة في المناطق الفقيرة التي يستوطن فيها هذا الداء، إلا أنها تعاني من انخفاض حساسيتها ويتطلب الحصول على نتائج هذه الطرق فترات تتراوح بين عدة أيام إلى عدة أسابيع. ويعزى انخفاض الحساسية إلى اعتماد هذه الطرق على عدد الطفيليات في العينة والمهارة التقنية في جمعها وخبرة الفاحص في التعرف على الطفيلي في العينة، فضلاً عن الصعوبات الأخرى التي تواجه الزرع من احتمال تلوث الوسط بالجراثيم والفطور، وصعوبة زرع بعض الأنواع مثل الليشمانية البرازيلية L. braziliensis (8).
أظهر اختبار kDNA PCR في دراستنا نتائج إيجابية في كل العينات (70/70)، حيث أظهرت العينات جميعها عصابة 120bp مطابقة للشاهد الإيجابي، بينما لم يظهر الشاهد السلبي أي عصابة. هذا وبينت نتائجنا أن العينات جميعها التي كانت سلبية بالفحص المباشر و/أو الزرع كانت إيجابية عند تطبيق اختبار kDNA PCR، الذي أظهر حساسية عالية بلغت 100%. وبما أنه لم تظهر نتائج ايجابية كاذبة في هذا الاختبار لذلك كانت النوعية 100%. وبلغت القيمة التنبؤية الإيجابية لهذا الاختبار 100%، أما القيمة التنبؤية السلبية فلقد بلغت 100% أيضاً.
توافقت نتائجنا مع نتائج دراسات Christina وزملائها عام 2006 وNasereddin وزملائه، عام 2008 وBarrio وزملائه عام 2007 الذين حصلوا على حساسية 100% عند تضخيم المجال المصان في الحلقات الصغيرة. بينما كانت حساسية اختبار kDNA-PCR التي حصلنا عليها أعلى من حساسيته المسجلة من قبل Bensoussan وزملائه عام 2006 والتي بلغت 98.7%، ومن الحساسية المسجلة من قبلKumar وزملائه عام 2007، حيث بلغت 96.6%.
ولقد توافقت نتائج نوعية الفحص المباشر والزرع في دراستنا مع نتائج نوعية تلك الطرق عند Bensoussan وKUMAR وChristina وزملائهم، حيث بلغت 100%. بينما تعارضت نتائج نوعية طريقة kDNA-PCR التي حصلنا عليها في دراستنا والتي بلغت 100% مع نتائج النوعية لتلك الطريقة عند Bensoussan وKUMAR والتي بلغت لديهم 57.1% و80%، على الترتيب.
وعند حساب قيم الـ PPV للفحص المباشر والزرع و ITS1-PCR كانت قيمتها 100%، مطابقة بذلك لنتائج دراسات Bensoussan وKumar الذين حصلوا على PPV=100% للاختبارات السابقة، أما بالنسبة لقيمة PPV التي حصلنا عليها لاختبار الـ KDNA PCR المطبق فكانت 100% وهي أعلى من تلك التي حصل عليها Bensoussan وKumar وزملاؤهم، حيث كانت 92.8% و96.6%، على الترتيب.
أما بالنسبة لقيم NPV للفحص المباشر والزرع التي حصلنا عليها فكانت 57.85% و59.32%، على الترتيب. وتعد قيم NPV التي حصلنا عليها أعلى من تلك التي حصل عليها Bensoussan وزملاؤه، حيث كانت للفحص المباشر والزرع 41.2% و 32.6%، على الترتيب، وأعلى من تلك التي حصل عليها Kumar، حيث بلغت 23% و16.7%، على الترتيب. أما بالنسبة لقيم NPV لاختبار KDNA PCR التي حصلنا عليها فلقد بلغت 100%. في حين بلغت قيم NPV لهذا الاختبار عند Bensoussan وزملائه 88.9%، في حين بلغت 66.7% في دراسة Kumar وزملائه.
وتشير مقارنة نتائج الاختبارات الثلاثة المطبقة على العينات إلى أن تفاعل kDNA PCR كان الأعلى حساسية، حيث بلغت حساسيته 100%، تلاه في المرتبة الثانية اختبار الفحص المباشر الذي بلغت حساسيته 72.9%، بينما كانت حساسية اختبار الزرع الأضعف، حيث بلغت 68.6%. ولقد توافقت هذه النتائج مع نتائج دراسات Bensoussan وKUMAR وChristina وزملائهم.
ولمعرفة ما إذا كان الفارق جوهرياً بين حساسية kDNA PCR وحساسية الفحص المباشر والزرع جرى حساب معامل كاي مربع فكانت قيمه X2=21.98 وX2=26.1، على الترتيب، وكانت قيم P-value الموافقة على الترتيب P=0.0006 وP=0.0001 وهي أقل من 0.05 وبالتالي الفارق بين حساسية kDNA PCR وحساسية كل من الفحص المباشر والزرع يُعتد به إحصائياً.
تعود قدرة اختبار KDNA-PCR على تشخيص العينات جميعها إلى ارتفاع حساسية هذا الاختبار بالمقارنة مع الفحص المباشر والزرع. يجري في اختبار KDNA-PCR تضخيم الجزء المصان conserved region من الحلقات الصغيرة minicircles في دنا منشأ الحركة، والبالغ 120bp والموجود في هذه الحلقات جميعها التي يبلغ عددها 104 نسخة، مما يجعله هدفاً مثالياً للتفاعل السلسلي للبوليميراز لكل أنواع الليشمانية (16). وعليه يمكن تفسير نتيجة العينات التي كانت إيجابية بطريقة تضخيم دنا منشأ الحركة فقط وسلبية بالفحص المباشر و/أو الزرع، بأنها عينات تحوي عدداً قليلاً جداً من الطفيليات. ونظراً للحساسية العالية التي تتمتع بها هذه الطريقة فقد تمكنت من كشف دنا الطفيليات في تلك العينات، بينما كان الفحص المجهري والزرع سلبيين. ومن الجدير بالذكر، أن الشاهد السلبي في تجربتنا لم يظهر أية عصابة تدل على وجود تلوث، مما يشير إلى عدم حدوث تلوث بالدنا خلال التضخيم.
|
 |
| المراجع References |
| |
1-Hajjaran H; Vasigheh F; Mohebali M; Rezaei S; Mamishi S and Charedar S.
Direct Diagnosis of Leishmania Species on Serosity Materials Punctured From Cutaneous Leishmaniasis Patients Using PCR-RFLP.
Journal of Clinical Laboratory Analysis, (25): 20-24, 2011.
2-Killiick-Kendrick R.
Phlebotomine vectors of the leishmaniasis.
Med. Vet. Entomol. 4: 1-24, 1990.
3-Bari A.
Choronology of cutaneous lishmaniasis:an overview of the history of the disease.
Journal of Pakistan Association of Dermatologists. 16: 24-27, 2006.
4-Maarouf M.
Distribution of cutaneous lishmaniasis in Damascus and its suburbs during 2002-2005.
Arab Journal of pharmaceutical sciences.2006; 3(3):39-51.
5-Gelpi A.
Alexander Russell and the Aleppo ulcer.
Int J Dermatol.1987; 26(2):131-134.
6-Ashford R; Rioux J; Jalouk L; Khiami A and Dye C.
Evedence for a long-term increase in the incidence of L. tropica in Aleppo, Syria.
Trans. Roy, Soc, Trop, Med. Hyg. 1993; 87(3): 247-249.
7-Dilmec F. and Matur A.
Investigation of Leishmania Parasites From Clinical Samples Using Polymerase Chain Reaction Technique in Cukurova Region, Turkey.
Harran Universitesi T?p Fakültesi Dergisi. 2008; 5(1): 10-14
8-Bensoussan E; Nasereddin A; Jonas F; Schnur F. and Jaffe L.
Comparison of PCR assays for diagnosis of cutaneous leishmaniasis.
J. Clin. Microbiol. 2006; 44(4): 1435-1439.
9-Profeta M; Rotondo D; Silva A; Oliveira F; Caligiorne B; Oliveira E. and Rabello A.
Lesion aspirate culture for the diagnosis and isolation of Leishmania spp. from patients with cutaneous leishmaniasis.
Mem. Inst Oswaldo Cruz Rio de Janeiro. 2009; 104: 62-66.
10-Reithinger R. and Dujardin J.
Molecular Diagnosis of Leishmaniasis: Current Status and Future Applications.
J. Clin. Microbiol. 2007; 45(1): 21-25.
11-Mugasa C; Laurent T; Schoone G; Basiye F; Saad A; Safi S; Kager P. and Schallig H.
Simplified molecular detection of Leishmania parasites in various clinical samples from patients with leishmaniasis Mugasa et al. Parasites & Vectors 2010; 3: 13.
12-Moaddeb A. and Behbahani A.
A Simple and Rapid DNA Purification Method for Detection of Leishmania DNA in Peripheral Blood of Patients with Visceral Leishmaniasis.
Shiraz E-Medical Journal. 2008.
13-Kumar R; Bumb R; Nasim A. and Rajesh D.
Cutaneous Leishmaniasis Caused By Leishmania Tropica In BIKANER, INDIA: Parasite Identification And Characterization Using Molecular And Immunologic Tools.
Am. J. Trop. Med. Hyg. 2007; 76(5): 896-901.
14-Christina A; Silva T; Cupolillo E; Volpini A; Almeida R. and Romero G.
Species diversity causing human cutaneous leishmaniasis in Rio Branco, state of Acre. Brazil. Tropical Medicine and International Health. 2006; 11 (9): 1388-1398.
15-Nasereddin A. Bensoussan-Hermano E; Scho¨nian G; Baneth G and Jaffe C.L.
Molecular Diagnosis of Old World Cutaneous Leishmaniasis and Species Identification by Use of a Reverse Line Blot Hybridization Assay.
J Clin Microbiol. 2008; 46(9): 2848-2855.
16-Noyes et al.
Structure of Leishmania Minicircle Kinetoplast DNA Classes.
J Clin. Microbiol. 1656-1657, 1999.
|
| |
| المجلد 6 ,
العدد 5
, جمادى الأولى 1433 - نيسان (أبريل) 2012 |
|
|
|
