| المجلد 6 ,
العدد 5
, جمادى الأولى 1433 - نيسان (أبريل) 2012 |
| |
| التيلوميرات والسرطان |
| Telomeres and Cancer |
| أ.د. ماهر المقداد |
| Dr. Maher Al-Mokdad |
جامعة ايبلا الخاصة، كلية الصيدلة، ادلب، سورية
Ebla Private University, Faculty of Pharmacy, Edleb, Syria
(مقال مُراجَعَة Review Article) |
| الملخص Abstract |
| التيلوميرات Telomeres هي متواليات متخصصة من DNA متكرر عند نهايات الصبغيات الخطية وهي تكون متشاركة مع بروتينات تعمل على صيانة تكامل الصبغيات. يعمل إنزيم التيلوميراز Telomerase وهو معقد بروتيني نووي ريبي على صيانة طول التيلومير. تتضمن بنية التيلوميراز جزءاً بروتينياً يتمثل بالناسخة العكسية التابعة للتيلوميراز Telomerase reverse transcriptase (TERT أو hTERT لدى البشر) و RNA تحفيزي Catalytic RNA (TERC). بغياب فعالية التيلوميراز فإن طول التيلوميرات تأخذ بالقصر بشكل مترق ٍ. تكون فعالية التيلوميراز غائبة في معظم الخلايا الجسدية السوية لدى البشر بسبب فقد التعبير عن الجزء TERT؛ بينما يكون الجزء TERC موجوداً عادة. وبدون التيلوميراز فإن قصر التيلوميرات يحد من نمو الخلايا، إما بالشُيُوْخَة (بدخولها حالة الشيخوخة) Senescence أو بالنوبة Crisis. يتسبب التعبير عن TERT في الخلايا التي تفتقد إلى فعالية التيلوميراز في تجاوز الشيوخة أو النوبة، ويُطلق عادة على مثل هذه الخلايا اسم خلايا خالدة أو خلايا سرطانية. |
| Telomeres are the specialized repetitive DNA sequences at the ends of the linear chromosomes, and associated proteins, that serve to maintain the integrity of the chromosomes. Telomerase is a ribonucleoprotein complex that maintains telomere length. The complex comprises the protein telomerase reverse transcriptase (TERT, or hTERT in humans) and a catalytic RNA (TERC). In the absence of telomerase activity telomeres progressively shorten. Telomerase activity is absent in most normal human somatic cells because of the lack of expression of TERT; TERC is usually present. Without telomerase, telomere shortening eventually limits the growth of cells, either by senescence, or by crisis. Expression of TERT in cells that otherwise lack telomerase activity causes cells to bypass senescence and crisis, and such cells are usually termed “immortalized cells or cancer cells. |
| المقدمة Introduction |
التيلوميـر هو منطقة مؤلفـة من متـواليات نوكليوتيدية متكررة في الـ DNA وهو يقع في نهاية الصبغي ويعمل على حماية الصبغي من التَدَهْوُر Deterioration أو من الانصهار Fusion مع الصبغيات المجاورة .
يشتق اسم التيلومير من الأسماء اليونانية التيلوز Telos التي نعني نهاية End ومن ميروز meros التي تعني جزء Part.
تحول مناطق التيلومير دون تدرك الجينات بالقرب من نهايات الصبغيات، عن طريق السماح بقصر نهايات الصبغيات والذي يحدث بالضرورة أثناء عملية تنسخ الصبغي Chromosome replication.
أثناء الانقسام الخلوي لا تستطيع الإنزيمات التي تقوم بمضاعفة الـ DNA الاستمرار في عملها إلى نهاية الصبغي. في حين أنه لو انقسمت الخلية بدون وجود التيلوميرات فستفقد نهايات صبغياتها وبالتالي ستفقد المعلومات التي تحوي عليها. فالتيلوميرات تعمل كدوارىء وتحصر نهايات الصبغيات. وهي تستهلك خلال انقسام الخلية ويتم تعويضها من قبل إنزيم ناسخة التيلوميراز العكسية Telomerase reverse transcriptase.
كان الروسي Alexei Olovnikov أول من بين في سبعينيات القرن الماضي وجود مشكلة تتمثل بأن الصبغيات لا تتنسخ بشكل كامل عند نهاياتها. وبناء على ذلك ولإيجاد تلاؤم مع فكرة Leonard Hayflick، التي تشير إلى الانقسام المحدود للخلايا الجسدية Somatic cell، فإن Olovnikov اقترح بأن هنالك متواليات نوكليوتيدية تُفقد في كل مرة يجري فيها تنسخ الـ DNA حتى الوصول إلى مستوى حرج ينتهي عنده انقسام الخلايا (1).
واكتشفت Elizabeth Blackburn، بين عامي 1975-1977، الطبيعة غير العادية للتيلوميرات، المؤلفة من متواليات متكررة من الـ DNA والتي تؤلف نهايات الصبغي. إن الآلية التي يقصر فيها التيلومير تحد بشكل طبيعي من الانقسام الخلوي بحيث لا يتجاوز عدد ثابت من الانقسامات، حيث اقترحت الدراسات التي أجريت على الحيوانات بأن ذلك يكون مسؤولاً عن كِبَر السِّنّ Aging على المستوى الخلوي، كما ويضع حداً لمَدَى العُمْر life-span.
تحمي التيلوميرات صبغيات الخلايا من الانصهار مع بعضها البعض، أو من عملية إعادة الترتيب Rearranging process وهي الشذوذات التي يمكن أن تتسبب بحدوث السرطان. وعليه فإن الخلايا تدمر عندما تستهلك التيلوميرات الخاصة بها. تعد غالبية السرطانات، نتيجة لوجود خلايا خالدة Immortal cells، بأنها تمتلك الوسائل التي تمكنها من مقاومة آلية التخريب المبرمجة السابقة Programmed destruction (2).
|
| بنية ووظيفة التيلوميرات Structure and function of Telomeres |
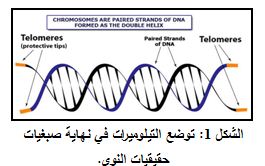
تعد التيلوميرات متواليات متكررة من الـ DNA والتي تقع في نهايات الصبغيات الخطية لمعظم الكائِنٌات الحَيّة حقيقيات النوى Eukaryotic organisms (الشكل 1). تمتلك معظم بدائيات النوى Prokaryotes صبغيات حلقية Circular chromosomes لذلك فان غالبيتها لا تمتلك تيلوميرات.
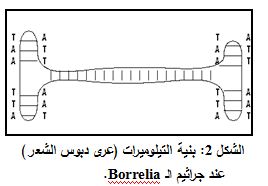
يكون جزء صغير من الصبغيات الجرثومية (مثل تلك التي تمتلكها جراثيم Streptomyces وBorrelia) خطية. وهي بالتالي تمتلك تيلوميرات تختلف عن تلك الموجودة في صبغيات حقيقيات النوى، من حيث البنية والوظيفة. إن البنيات المعروفة للتيلوميرات الجرثومية تأخذ شكل بروتينات ترتبط إلى نهايات الصبغيات الخطية أو شكل عرى دبوس الشعر Hairpin loops التابع للـ DNA مفرد الطاق Single-stranded DNA والتي تتوضع عند نهايات الصبغيات الخطية (الشكل 2) (3).
أثناء عملية تنسخ الـ DNA فإن الإنزيمات المسؤولة عن تنسخ DNA حقيقيات النوى (معقد DNA بوليميراز- بروتين DNA polymerase protein complex) لا تستطيع مضاعفة المتواليات النوكليوتيدية الموجودة عند نهايات الصبغيات. ولهذا فإن هذه المتواليات والمعلومات التي تحملها يمكن أن تفقد. للسبب السابق فإن التيلوميرات تعد هامة جداً في سياق انقسام الخلية الناجح، كونها تغطي المتواليات النهائية بينما تفقد هي في عملية تنسخ الـ DNA. ولكن الخلية تمتلك إنزيم يسمى التيلوميراز Telomerase الذي يقوم بمهمة إضافة متواليات نوكليوتيدية متكررة إلى نهايات الـ DNA. ولهذا يعيد التيلوميراز تشكيل التيلومير الذي يغطي نهايات الـ DNA.
في معظم الكائنات الحية حقيقيات النوى متعددة الخلويةMulticellular eukaryotic organisms توجد فعالية التيلوميراز فقط في الخَلايا الجِنْسِيَّة Germ cells? والخلايا الجذعية Stem cells? وفي خلايا دم بيضاء معينة.
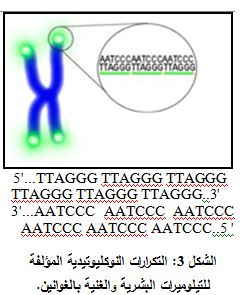
يختلف طول التيلوميرات بشكل كبير بين الأنواع، فهو 300 زوج أساس تقريباً في الخميرة (4) وعدد من الكيلو أساس Kilobases عند البشر. وتتألف التيلوميرات من مصفوفات Arrays من التكرارات المكونة من 8-6 أزواج أسس وتكون غنية بالغوانين (الشكل 3).
تنتهي تيلوميرات حقيقيات النوى في النهاية 3` بـ DNA مفرد الطاق والذي يكون ضرورياً لصيانة Maintenance التيلومير ولوظيفة التقبيع Capping.
جرى أيضاً استعراف العديد من البروتينات التي ترتبط بالـ DNA مفرد ومضاعـف الطـاق
5'...TTAGGG TTAGGG TTAGGG TTAGGG TTAGGG TTAGGG..3'
3'...AATCCC AATCCC AATCCC AATCCC AATCCC AATCCC..5 '
للتيلومير والتي تعمل من أجل صيانة التيلومير وعملية التقبيع Capping (5).
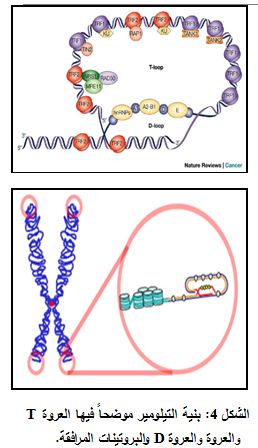
تشكل التيلوميرات بنى تأخذ شكل عروة كبيرة تدعى عرى التيلومير Telomere loops أو العرى T (T-loops). يتجعد طاق الـ DNA المفرد بشكل دائرة طويلة يجري تثبيتها من قبل البروتينات الرابطة للتيلومير (6) (الشكل 4).
عند نهاية الـ T-loop فإن DNA التيلومير مفرد الطاق يتم حمله ضمن منطقة من الـ DNA مضاعف الطاق، مؤدياً ذلك إلى تشكل ما يعرف بالعروة D (D-loop) (7).
يمكن لقصر التيلومير عند البشر أن يحدث شُيُوْخَة التنسخ Replicative senescence والتي تحصر عملية انقسام الخلايا. يبدو أن هذه الآلية تعمل على منع عَدَمُ الاستِقْرار المجيني Genomic instability وتطور السرطان في الخلايا البشرية الشائخة، عن طريق الحد من الانقسامات الخلوية.
|
|
إن الخلايا الخبيثة التي تتجاوز التوقف عن الانقسامات الخلوية تصبح خالدة، عن طريق إطالة التيلومير نتيجة لتنشيط التيلوميراز لإنزيم الناسخة العكسية المسؤول عن اصطناع التيلوميرات.
إلا أن %10–5 من السرطانات البشرية تنشط من مسلك بديل لإطالة التيلوميرات Alternative Lengthening of Telomeres (ALT) pathway والذي يعتمد على إطالة متواسطة بالتأشيب recombination-mediated elongation
نظراً للاعتقاد بأن التيلوميرات الأقصر هي سبب سوء الصحة والتَشَيُّخ، فإن ذلك يطرح تساؤلاً عن عدم اختيار التيلوميرات الأطول من أجل تخفيف تأثيرات التيلوميرات القصيرة. يقترح الإيضاح الأبرز بأن وراثة التيلوميرات الأطول تسبب زيادة في معدلات الإصابة بالسرطان. إلا أن أحد المراجع الحديثة (8) يقترح، بشكل مخالف، أن السبب في ذلك هو كون التيلوميرات القصيرة وعدم تنشيط التيلوميراز يترافق غالباً مع زيادة معدلات السرطان. وأن الوفاة من السرطان تحدث في أواخر الحياة، عندما تكون قوة الانْتِقاء الطبيعي natural selection منخفضة جداً. ويتمثل الإيضاح البديل لفرضية عدم اختيار التيلوميرات الطويلة، العائد لتأثيراتها المنشطة للسرطان، بفرضية التيلومير المقتصد thrifty telomere، التي تقترح بأن تأثيرات التكاثر الخلوي cellular proliferation للتيلوميرات الطويلة يسبب زيادة في نفقات الطاقة energy expenditures (8)، في بيئات ذات محدودية طاقية، لذلك فإن التيلوميرات القصيرة يمكن أن تمثل آلية مقتصدة للطاقة.
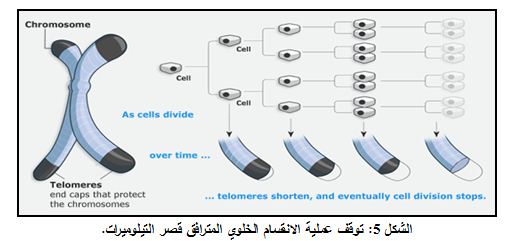
تفقد الخلايا الجسدية البشرية human somatic cells التي لا تمتلك التيلوميراز المتواليات التيلوميرية بشكل تدريجي، كنتيجة لعملية التنسخ غير الكاملة. وكلما ازدادت التيلوميرات قصراً فإن الخلايا تصل إلى محدودية في قدرتها التنسخية، بحيث تسير باتجاه التَشَيُّخ senescence (الشكل 5).
يتضمن التَشَيُّخ مسالك مثل p53 وpRb وهي تؤدي إلى توقف تكاثر الخلية. وربما يلعب التَشَيُّخ دوراً هاماً في تثبيط نشوء السرطان cancer emergence، على الرغم من أن وراثة تيلوميرات أقصر لا تقي من احتمال الإصابة بالسرطان.
إن وجود تيلوميرات قصيرة هو نقطة حرجة لتكاثر خلوي إضافي، يمكن أن يحدث عن طريق عدم تنشيط مسلكي p53 وpRb. وتخضع الخلايا التي تتكاثـر بعد عملية عدم تنشــيط المسلكين السابقين إلى ما يعرف بالنوبة crisis.
تتصف النوبة بإعادة ترتيبات صبغانية كبرية gross chromosomal rearrangements وعدم ثبات جينومي وتموت الخلايا جميعها تقريباً. ويمكن لخلايا قليلة جداً أن تنشأ من النوبة بحالة خلايا خالدة، من خلال عملية إطالة التيلومير الخاص بها (إما بتنشيط التيلوميراز أو بإطالة التلوميرات البديل). وتتصف الخلايا التي تستخدم مسلك ALT كون تيلوميراتها متغايرة في الطول بشكل كبير ولذلك اقترحت آلية التأشيب recombination. وأثبتت الدراسات اللاحقة دور التأشيب في صيانة التيلومير بواسطة مسلك ALT. إلا أن الآلية الدقيقة لهذا المسلك لم تحدد بعد.
|
| التيلوميراز Telomerase |
التيلوميراز عبارة عن معقد بروتين ٌ نَوَوِيٌّ ريبوزيّ ribonucleoprotein complex، مؤلف من مكون بروتيني protein component ومتوالية مَشْرَع RNA (RNA primer sequence)، يعمل لحماية النهايات الانتهائية للصبغيات terminal ends of chromosomes. تعد أعمال التيلوميراز ضرورية، نظراً لأنه خلال التنسخ يستطيع إنزيم DNA polymerase اصطناع الـ DNA فقط بالاتجاه من 5´ إلى 3´ عن طريق إضافة عديدات النوكليوتيد الى مَشْرَع الـ RNA الذي يتوضع في نقاط مختلفة على طول الـ DNA.
ينبغي استبدال طيقان الـ RNA مؤخراً بالـ DNA. ولا تمثل عملية استبدال مَشارع الـ RNA مشكلة في أماكن نشوء التنسخ، ضمن الصبغي، لأن إنزيم DNA polymerase يستطيع استخدام امتدادت DNA 5´ سابقة لمرصاف الـ RNA لإعادة ملء التسلسل مكان وجود مَشْرَع الـ RNA. إلا أنه في النهاية الانتهائية للصبغي فإن إنزيم DNA polymerase لا يستطيع استبدال مَشْرَع الـ RNA بسبب عدم وجود الموقع 5´ لمَشْرَع الـ RNA، حيث يمكن لمَشْرَع آخر أن يتوضع. ولا يوجد DNA، بحيث يمكن أن يستخدم كمَشْرَع يمكّن إنزيم DNA polymerase من استبدال مَشْرَع الـ RNA.
بدون وجود التيلوميرات فإنه سيجري حذف المتواليات الجينية عند نهاية الصبغي. ويتناقص بذلك طول الصبغي في عمليات التنسخ اللاحقة. وهو ما سيترافق بفقد للمعلومات الجينية. فالتيلوميرات تمنع حدوث المشكلة السابقة بآلية مختلفة لاصطناع الـ DNA عند تلك النقطة. ولذلك فهي تحفظ المتوالية عند نهاية الصبغي.
تمنع العملية السابقة تدهور الصبغي، كما تمنع نهايات الصبغي من أن تتكون بشكل DNA مكسور مضاعف الطاق double-strand DNA break، مما يؤدي إلى انصهار نهايات الصبغي مع بعضها البعض.
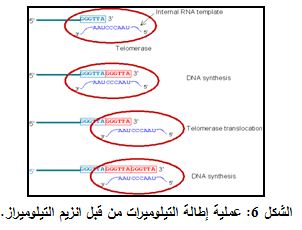
تجري إطالة التيلوميرات بتوسط التيلوميراز، الذي يشكل جزء من مجموعة فرعية من البروتينات تتبع إنزيمات الناسخة العكسية Reverse transcriptase المتخصصة (التي تعرف باسم (Telomerase Reverse Transcriptases "TERT") والتي تشترك في عملية اصطناع التيلوميرات عند البشر وعند عدد من الكائنات الحية وليس كلها (الشكل 6).
إلا أنه وبسبب آليات تنسخ الـ DNA? الإجهاد التأكسدي oxidative stress وبسبب انخفاض التعبير عن TERT (وهو منخفض جداً في العديد من أنماط الخلايا البشرية) فإن تيلوميرات هذه الخلايا تنكمش وتتقلص قليلاً في كل مرة تنقسم فيها الخلية. على الرغم من أن أنواع خلوية أخرى تحتاج إلى انقسام خلوي شديد، مثل الخلايا الجذعية وخلايا بيضاء معينة، يُعبّر فيها عن TERT بمستويات عالية ويقصر التيلومير فيها جزئياً أو يمنع تشكله .
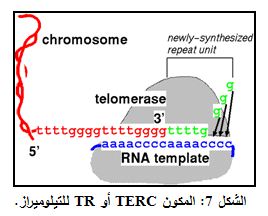
بالإضافة الى TERT، المكون البروتيني، فإن إنزيم التيلوميراز يحوي قطعة تمثل RNA مرصاف يعرف بمكون RNA تيلوميراز (TERC) Telomerase RNA Component أو تيلوميراز RNA (TR) Telomerase RNA (الشكل 7). ومتوالية TERC عند البشر هي عبارة عن تكرار من TTAGGG طوله بين 3-20 كيلو أساس Kilobases.
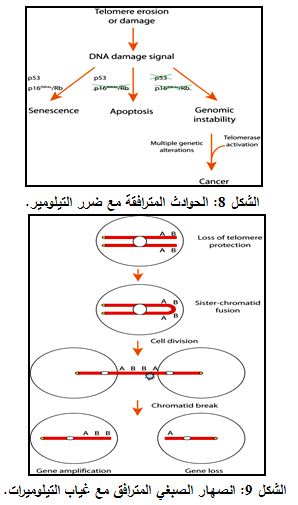
إذا أصبح التيلومير قصيراً جداً يمكن للخلية أن تعين حالة من عدم التقبيع كضرر للـ DNA. ومن ثم إما التوقف عن النمو أو التشيخ أو تبتدأ عملية التدمير الذاتي المبرمج للخلية والذي يعرف بالاستماتة apoptosis، اعتماداً على الخلفية الوراثية للخلية (حالة p53) (الشكل 8).
سيؤدي غياب التيلوميرات كذلك إلى اندماج الصبغيات (الشكل 9). وبما أن هذا الضرر لا يمكن إصلاحه في الخلايا الجسـدية فإن الخلية يمكن أن تدخل في مرحلة الاستماتة.
إن العديد من الأمراض ذات العلاقة بكبر السن ترتبـط بقصر التيلوميرات. وتتردى الأعضاء
حالما تزداد عملية موت خلاياها أو دخولها في الشيخوخة الخلوية (التشيخ).
|
|
| قصر التيلوميرات Telomere shortening |
يقصر التيلومير جزئياً بسبب مشكلة نهاية التنسخ end replication problem والتي تظهر خلال عملية تنسخ الـ DNA عند حقيقيات النوى فقط.
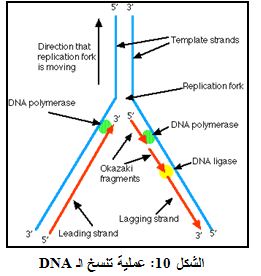
نظراً لأن تنسخ الـ DNA لا يبتدأ عند أي من نهايات طاق الـ DNA وإنما يبتدأ في المركز، وبالأخذ بعين الاعتبار أن إنزيمات DNA polymerases جميعها تتحرك بالاتجاه من 5´ إلى 3´، فإنه سيكون هناك ما يعرف بالطاق القائد leading strand والطاق المتلكأ أو المتأخـر lagging strand على جزيئة الـ DNA التي يجري تنسخها.
يمكن للـ DNA polymerase أن يقوم باصطناع متتم للطاق القائد بدون أية صعوبة لأنه يقوم بالتحرك بالاتجاه من 5´ إلى 3´. إلا أنه يوجد مشكلة بالتوجة في الاتجاه الآخر على الطاق المتلكأ أو المتأخر. ولمواجهة ذلك فإن تسلسلات قصيرة تعمل كمَشْارع Primers تتصل إلى الطاق المتلكأ، على مسافة قصيرة من الناحية العليا لموقع البدأ Initiation site، حيث تقوم إنزيمات DNA polymerase ببدىء التنسخ عند تلك النقطة وتتجه نحو نهاية موقع البدء. وتؤدي العملية السابقة الى تشكل ما يعرف بشدف اوكازاكي Okazaki fragments. تتصل بادئات أخرى من الـ RNA الى الـ DNA ويتابع إنزيم DNA polymerase عمله لصنع طاق جديد.
في نهاية الأمر يتصل مَشْرَع الـ RNA الأخير. ومن ثم تقوم إنزيمات DNA polymerase وRNA nuclease و DNA ligase بتحويل الـ RNA المشكل للمَشارع إلى DNA وبلحم الفجوات الموجودة بين شدف أوكازاكي (الشكل 10).
ولكن لتغيير الـ RNA الى DNA ينبغي أن يكون هنالك طاق DNA أمام مَشْرَع الـ RNA. ويحدث ذلك في كل مواقع الطاق المتلكأ ولكنه لا يحدث عند النهاية، في مكان اتصال مَشْرَع الـ RNA الأخير. وفي النهاية فإن ذلك الـ RNA يجري تدميره من قبل إنزيم يقوم بتدرك أي RNA يبقى على الـ DNA. وأظهرت الدراسات التي أجريت في الزجاج التقبل المرتفع للتيلوميرات للإجهاد التأكسدي Oxidative stress. ويفسر قصر التيلومير بسبب الجذور الحرة الاختلاف بين الخسارة المقدرة في كل انقسام خلوي بسـبب مشكلة نهاية التنسخ، والذي
يقدر بـ 20 زوج أساس، وبين معدلات قصر التيلومير الفعلية والتي تقدر بـ 50-100 زوج أساس والتي تمتلك تأثيراً مطلقاً أكبر على طول التيلومير.
|
| إطالة التيلوميرات Lengthening telomeres |
لقد لوحظت ظاهرة الانقسام الخلوي المحدود من قبل Leonard Hayflick والتي يشار إليها حالياً بحد Hayflick Hayflick limit. وإن إطالة حياة الإنسان قد عززت فكرة إطالة التيلوميرات في خلايا معينة، من خلال التنشيط المؤقت للتيلوميراز بتأثير أدوية معينة، أو من خلال احتمال التنشيط الدائم بالمعالجة الجينية Gene therapy. وعليه يمكن إطالة حياة الإنسان لكونها ستتجاوز حد Hayflick. ولقد أظهرت الأفكار السابقة أن إطالة التيلوميرات قد عكست بنجاح بعض مظاهر التشيخ (كبر السن) عند الفئران المخبرية (9) والدودة الممسودة Nematode worm (10) على الرغم من أنه
لم يبرهن على ذلك عند البشر. إلا أنه افترض أن التيلوميرات الأطول، وخصوصاً تنشيط التيلوميراز، قد يسبب زيادة السرطان. والأمر المتعارض مع ذلك أن التيلوميرات الأطول يمكن أيضاً أن تقي من حدوث السرطان، حيث أن التيلوميرات القصيرة تترافق مع السرطان. كما جرى الاقتراح أن التيلوميرات الأطول يمكن أن تسبب زيادة استهلاك الطاقة (11).
قد تكون التقنيات المستخدمة لإطالة التيلوميرات مفيدة لعملية هندسة النسج tissue engineering، لأنها يمكن أن تسمح بزراعة الخلايا الثديية السوية، غير السرطانية، بكميات كافية لهندسة مواد تستخدم في الإصلاح الحيوي الطبي. إلا أنه لا تزال هنالك العديد من نقاط الخلاف والنقاش التي تحتاج إلى التفسير والإيضاح. وتتمثل أحد الأمور بأنه لا يوجد تأكيد في ما إذا كانت العلاقة بين التيلوميرات والتشيخ هي علاقة سببية. حيث يترافق التبدل في أطوال التيلومير عادة مع تبدل في سرعة التشيخ Senescence. إلا أن قصر التيلومير قد يكون نتيجة وليس سبباً لعملية التشيخ.
تتوضح صعوبة فهم دور التيلوميرات من خلال نتائج دراستين، أوضحت إحداهما أن طول التيلوميرات عند أحد أنواع طيور البحر sea birds طويلة العمر يزداد بتقدم العمر (11). إلا أن الدراسة الأخرى التي أجريت على أنواع أخرى من طيور البحر طويلة العمر (12) أظهرت تناقص طول التيلومير حتى عمر 40 عاماً، إلا أن سرعة هذا التناقص تنخفض بشكل كبير مع ازدياد العمر. وإن معدلات تناقص طول التيلوميرات تختلف بشكل كبير بين أفراد الطيور. وجرى الاستنتاج بأن عند هذه الأنواع من الطيور فإن طول التيلومير لا يمكن أن يستخدم بشكل كافٍ لتحديد عمر الطائر. وعليه فإنه يبدو وجود تبدلات في طول التيلومير أكثر مما كان يعتقد في البداية.
|
| التيلوميرات والسرطان Telomeres and cancer |
حالما تبدأ الخلية بأن تصبح سرطانية فإنها تنقسم بشكل أكبر وتصبح تيلوميراتها أقصر. وإذا أصبحت التيلوميرات قصيرة جداً فإن الخلية يمكن أن تموت. ويمكن للخلية أن تهرب من الموت بزيادة التنظيم صعداً Up-regulating لإنزيم التيلوميراز Telomerase، الذي يمنع التيلوميرات من أن تصبح أقصر وكذلك يقوم بإطالتها.
أظهرت الدراسات وجود تيلوميرات قصيرة في العديد من السرطانات كسرطان البنكرياس? والعظم? والموثة? والمرارة? والرئة? والكلية? والعنق? والرأس. بالإضافة لذلك فإن الأشخاص الذين لديهم أنواعاً عديدة من السرطان قد أظهروا امتلاكهم لتيلوميرات أقصر تابعة للكريات البيضاء مقارنة مع تيلوميرات الكريات البيضاء للأشخاص الأصحاء (13).
تتطلب الخلايا السرطانية آلية للمحافظة على الـ
DNA التيلوميري لتتابع انقسامها بشكل لا محدود. وتعد الآلية المستخدمة لإطالة التيلومير أو المحافظة عليه واحدة من الخطوات الرئيسية في عملية الخلود الخلوي والتي يمكن استخدامها كواصم تشخيصي. ويتم تنشيط التيلوميراز، المعقد الإنزيمي المسؤول عن إطالة التيلوميرات، في حوالي 90% من الأورام. إلا أن أجزاء قابلة للقياس من الخلايا السرطانية تستخدم تطويلاً بديلاً للتيلومير alternative lengthening of telomeres (ALT) (14) والذي يتمثل بمسلك تطويل للتيلومير غير محافظ non-conservative telomere lengthening pathway وهو يتضمن نقل تكرارات تيلوميرية بين شقي الصبغي chromatids (15).
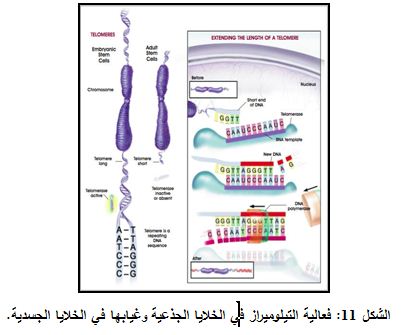
التيلوميراز إنزيم طبيعي يعزز من عملية إصلاح التيلومير. ويكون التيلوميراز فعالاً في الخلايا الجذعية? الخلايا الانتاشية? جريبات الشعر، في %90 من الخلايا السرطانية. ولكن التعبير عنه يكون منخفضاً أو غائباً في الخلايا الجسدية somatic cells. وتتمثل وظيفة التيلوميراز بإضافة الأسس الى نهايات التيلوميرات (الشكل 11).
تُعد الخلايا التي تمتلك فعالية تيلوميراز كافية خلايا خالدة، كونها تستطيع الانقسام دون أن تدخل مرحلة التشيخ senescence أو الاستماتة الخلوية apoptosis. ولهذا السبب فإن التيلوميراز يعد هدفاً محتملاً للأدوية المضادة للسرطان (16).
أظهرت الدراسات التي أجريت على الفئران بأن دور التيلوميرات في السرطان يتظاهر بالتأثير على نمو الورم وتعزيز عملية تَكَوُّنُ الأَورام tumorigenesis وذلك اعتماداً على نمط الخلية والمحتوى الجينومي (17، 18).
|
|
| الاستنتاج Conclusion |
| حتى بوجود علاقة سببية واضحة بين قصر التيلوميرات المترقي والشيخوخة الخلوية من جهة? وبين التكاثر اللامحدود للخلايا ثابتة طول تيلوميراتها (بتأثير التيلوميراز) من جهة أخرى، فإن الأسئلة العديدة الذي تحتاج إلى إجابة تتمثل بأي من الجينات المرمزة لمكونات التيلوميراز? وهل تنظيم الـ RNA التابع لهذا الإنزيم وبروتيناته يجري على المستوى الانتساخي transcriptional level أم على المستوى ما بعد الانتساخي Posttranscriptional level? وهل تنظيم هذه المكونات يحدد فعالية الإنزيم؟? وهل توجد آليات داخل خلوية تقوم بكظم فعل التيلوميراز؟. وبالاعتماد على المعلومات الحالية عن آليات التيلوميرات والتيلوميراز فإن الجهود ينبغي أن تبذل للإجابة عن الأسئلة السابقة ولاستخدام النتائج الجديدة من أجل تطوير أدوات تشخيصية واستراتيجيات علاجية للسرطان. |
| المراجع References |
1-Olovnikov A.M.
A theory of marginotomy. The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon.
J Theor Biol, 41 (1): 181-190, 1973.
2-Robert G.F, and Dan L.L.
Cancer cell biology and angiogenesis.
Harrison's Principles of Internal Medicine, 69: 454.
3-Maloy S.
Bacterial Chromosome Structure. http://www.sci.sdsu.edu/~smaloy/MicrobialGenetics/topics/chroms-genes-prots/chromosomes.html. 2002.
4-Shampay J, Szostak J.W, and Blackburn E.H.
DNA sequences of telomeres maintained in yeast.
Nature, 310: 154-157, 1984.
5-Greider C.W.
Telomere length regulation.
Annu Rev Biochem, 65: 337-365, 1996.
6-Griffith J, Comeau L, Rosenfield S, Stansel R, Bianchi A, Moss H. and de Lange T.
Mammalian telomeres end in a large duplex loop.
Cell, 97 (4): 503-514, 1999.
7-Burge S, Parkinson G, Hazel P, Todd A. and Neidle S.
Quadruplex DNA: sequence, topology and structure.
Nucleic Acids Res, 34 (19): 5402-15, 2006.
8-Eisenberg D.T.A.
An evolutionary review of human telomere biology: The thrifty telomere hypothesis and notes on potential adaptive paternal effects.
American Journal of Human Biology, 23 (2): 149-167, 2011.
9-Sample I.
Harvard scientists reverse the ageing process in mice - now for humans.
The Guardian (London), 2010.
10-Joeng K.S, Song E.J, Lee K.J. and Lee J.
Long lifespan in worms with long telomeric DNA.
Nature Genetics, 36 (6): 607-611, 2004.
11-Nakagawa S, Gemmell N.J. and Burke T.
Measuring vertebrate telomeres: applications and limitations.
Mol. Ecol. 13 (9): 2523-2533, 2004.
12-Juola, F.A, Haussmann M.F, Dearborn D.C. and Vleck C.M.
Telomere shortening in a long-lived marine bird: Cross-sectional analysis and test of an aging tool.
The Auk 123 (3): 775, 2006.
13-Willeit P, Willeit J, Mayr A, Weger S, Oberhollenzer F, Brandst?tter A, Kronenberg F. and Kiechl S.
Telomere length and risk of incident cancer and cancer mortality.
JAMA, 304 (1): 69-75, 2010.
14-Henson J.D, Neumann A.A, Yeager T.R. and Reddel R.R.
Alternative lengthening of telomeres in mammalian cells.
Oncogene, 21 (4): 598-610, 2002.
15-Chris M, Karien W, Nico P.V, Shadi K, Roland E, Hans J.T. and Roeland W. D.
Visualizing telomere dynamics in living mammalian cells using PNA probes.
The EMBO Journal, 22 (24): 6631-6641, 2003.
16-Philippi C, Loretz B, Schaefer U.F. and Lehr C.M.
Telomerase as an emerging target to fight cancer-Opportunities and challenges for nanomedicine.
Journal of Controlled Releases, 146 (2): 228-240, 2010.
17-Chin L, Artandi S.E, Shen Q. et al.
p53 deficiency rescues the adverse effects of telomere loss and cooperates with telomere dysfunction to accelerate carcinogenesis.
Cell, 97 (4): 527-538, 1999.
18-Greenberg R.A, Chin L, Femino A. et al.
Short dysfunctional telomeres impair tumorigenesis in the INK4a(delta2/3) cancer-prone mouse.
Cell, 97 (4): 515-525, 1999.
|
| |
| |
| المجلد 6 ,
العدد 5
, جمادى الأولى 1433 - نيسان (أبريل) 2012 |
|
|
|
